
| X | Y | ||
| Z | W |
| A. | X元素不能形成氧化物 | |
| B. | Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | |
| C. | X元素的非金属性比Y元素非金属性强 | |
| D. | 四种元素中,原子半径最小的元素是Y |
分析 X、Y、Z、W均为短周期元素,由元素在周期表中的位置知,X和Y属于第二周期元素,Z和W属于第三周期元素,X、Z的质子数之和为21,且X和Z的原子序数相差7,设X的质子数为x,则x+x+7=21,解得x=7,可知X是N元素,所以Z是Si元素、Y是F元素、W是S元素,再结合元素周期律及物质结构解答.
解答 解:X、Y、Z、W均为短周期元素,由元素在周期表中的位置知,X和Y属于第二周期元素,Z和W属于第三周期元素,X、Z的质子数之和为21,且X和Z的原子序数相差7,设X的质子数为x,则x+x+7=21,解得x=7,可知X是N元素,所以Z是Si元素、Y是F元素、W是S元素,
A.N的氧化物有NO、NO2等,故A错误;
B.Y为F元素,无正价,所以没有最高价含氧酸,故B错误;
C.同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以F元素的非金属性大于N元素,故C错误;
D.电子层越多,原子半径越大,同周期从左向右原子半径减小,则四种元素中原子半径最小的元素是Y,故D正确;
故选D.
点评 本题考查位置、结构与性质的关系,为高频考点,把握原子结构、元素的位置与性质、元素周期律为解答的关键,综合性较强,侧重分析与应用能力的考查,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:多选题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=890.3 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
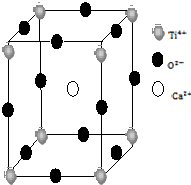 金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.
金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
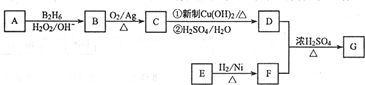
 .
. .
.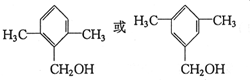 (写出一种即可).
(写出一种即可).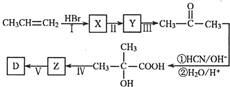
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 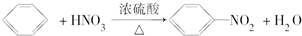 | |
| C. | CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3COOC2H5+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | N2的电子式: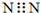 | ||
| C. | 硫离子结构示意图: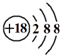 | D. | CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
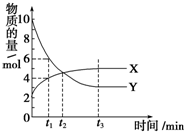 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为3X(g)?7Y(g) | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等 | |
| D. | 0到t1时间段内,Y的平均反应速率为4/t1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
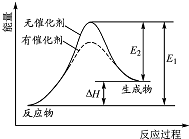 某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )| A. | 催化剂能改变该反应的焓变 | B. | 催化剂能降低该反应的活化能 | ||
| C. | 该反应为放热反应 | D. | E1 越大,表明该反应越容易发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com