
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下图,

下列说法正确的是( )
A. 313K时,根据曲线计算可知Ksp(SrSO4) 数量级为10-5
B. 三个不同温度中,313 K时Ksp(SrSO4)最大
C. 283 K时,图中a点对应的溶液是饱和溶液
D. 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
【答案】B
【解析】
A.根据表中数据计算,在313K时,Ksp(SrSO4)=c(Sr2+)c(SO42-)=10-1.45-1.65=10-3.1数量级不为10-5,A项错误;
B.由图像可知,在c(SO42-)或c(Sr2+)相同的条件下,313K时另一种离子的浓度最大,则313K时Ksp(SrSO4)最大,B项正确 ;
C.283K时,位于沉淀溶解平衡曲线上的点达到沉淀溶解平衡,a点在283K曲线的下方,离子浓度乘积小于283K时的Ksp(SrSO4),为不饱和溶液,C项错误;
D.283K下的SrSO4饱和溶液升温到363 K后,Ksp(SrSO4)减小,溶解平衡逆向移动,会有晶体析出,还是饱和溶液,D项错误;
所以答案选择B项。


科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
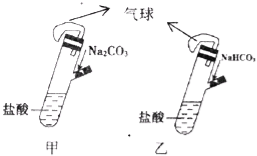
A. 甲装置的气球膨胀速率大
B. 若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C. 若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D. 最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的实验装置可用来测定含两种元素的某种气体 X 的分子式。

在注射器A中装有240mL气体 X 慢慢通过不含空气并装有红热的氧化铜的玻璃 管B,使之完全反应,得到下面的实验结果:
实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集的气体是氮气。试回答下列问题:
(1)X气体是由______(填元素符号)元素组成的。
(2)若240mLX气体完全反应后,收集到的氮气质量是0.28g。根据实验时温度和压强计算 1molX气体的体积是24000mL,则X的摩尔质量是______。
(3)通过计算确定X的分子式为________。
(4)写出B中发生反应的化学方程式__________。(X在该条件下不发生分解反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有硫酸钠、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钠提纯,某同学设计的实验流程如图:
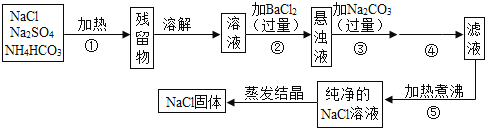
试回答下列问题:
(1)操作①的目的是_______。操作②能否用硝酸钡溶液?________(填“能”或“否”)。
(2)进行操作②后,如何判断SO42-已除尽,方法是_______。
(3)写出操作③有关的化学反应方程式_______。操作④的名称是_______。
(4)此设计方案是否严密,说明理由________。
(5)原固体样品中含NaClm1g,最后得到的NaCl固体m2g,则m1_______m2(填“>”、“<”或“﹦”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
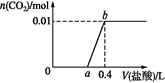
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述错误的是( )
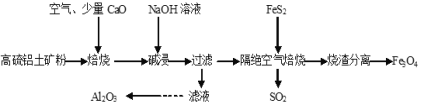
A.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
B.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
D.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)光束通过Fe(OH)3胶体,可看到光亮的通路,这种现象叫________;
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,求ACl2的摩尔质量________
(3)在标准状况下,测得4.2g气体A的体积是3360mL,则A可能是什么气体________
(4)在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:CO2和CO的体积之比是________。
(5)在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。所得盐酸物质的量浓度分别是________
(6)现有以下物质:①NaCl晶体 ②盐酸 ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧浓H2SO4 ⑨KOH固体;以上物质中属于电解质的是________
(7)Ca(HCO3)2溶液与少量氢氧化钠溶液混合的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七叶树内酯的结构如下图,若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
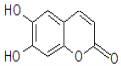
A. 2molBr2、2molNaOHB. 2molBr2、3molNaOH
C. 3molBr2、4molNaOHD. 4molBr2、4molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com