
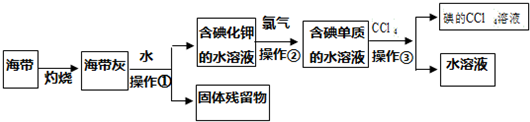
分析 由流程可知,海带灼热、溶解后,溶液中含碘化钾,则①过滤分离出固体残留物,得到含碘化钾I的溶液通入氯气,②发生2I-+Cl2═I2+2Cl-,③为萃取得到碘的四氯化碳溶液、水溶液,
(1)将海带烧成灰,向灰中加水搅拌;分离固体和液体用过滤;
(2)四氯化碳和水不互溶,且碘在四氯化碳中的溶解度大于水中的溶解度,碘溶于四氯化碳后溶液呈紫红色,据此分析解答;
(3)根据萃取的步骤:溶液和萃取液分别倒入分液漏斗,把分液漏斗倒转过来用力振荡,将分液漏斗放在铁架台上静置,待液体分层后,将漏斗上端玻璃塞打开,从下端放出下层液体,上端倒出上层液体,进行解答;
(4)根据蒸馏操作中所用的仪器分析解答;根据温度计在该装置中的位置与作用来分析,蒸馏需要测定馏分的温度;锥形瓶中收集到物质的名称根据从含碘的有机溶剂中经过蒸馏可以提取碘和回收有机溶剂,有机溶剂为四氯化碳.
解答 解:(1)过滤适用于分离不溶于水的固体和液体,海带灰难溶于水,碘元素以碘离子的形式存在于溶液中,所以将海带烧成灰,向灰中加水搅拌用过滤分离它们;
故答案为:溶解;过滤;
(2)根据四氯化碳能萃取碘水中的碘,但密度大于水的密度,看到的现象是溶液分层,碘溶解四氯化碳中呈紫红色,所以下层呈紫红色,上层是水层,呈无色,
故答案为:溶液分层,上层为水层接近无色,下层为CCl4层呈紫红色;
(3)根据萃取的实验操作,打开分液漏斗的玻璃塞(或将分液漏斗玻璃塞上的凹槽对准漏斗颈的小口),目的是为了使漏斗内外空气相通,以保证进行液体顺利流出,再转动打开活塞,使下层液体缓慢流下后,因上层液体从下口流出,产生杂质,所以关闭活塞,将上层液体从上口倒出,
故答案为:打开分液漏斗的玻璃塞(或将分液漏斗玻璃塞上的凹槽对准漏斗颈的小口),再转动打开活塞,使下层液体缓慢流下后,关闭活塞,将上层液体从上口倒出;
(4)从含碘的有机溶剂中经过蒸馏可以提取碘和回收有机溶剂,蒸馏操作中所用的仪器有:带铁圈的铁架台,酒精灯,石棉网,蒸馏烧瓶,温度计,冷凝管,牛角管,锥形瓶(接收器),该实验需要的主要玻璃仪器除酒精灯、烧杯、温度计、锥形瓶、牛角管外,还需要蒸馏烧瓶、冷凝管;因温度计测量的是蒸汽的温度,故应放在支管口,
故答案为:蒸馏烧瓶;冷凝管;蒸馏烧瓶支管口处.
点评 本题主要考查海洋中的有用成分的提取方法及实验操作,明确实验室氯气的制法、过滤、蒸馏操作是解答本题的关键,题目难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 锌是负极,发生氧化反应 | |
| B. | 锌的质量减少6.5g,外电路中通过0.4mol电子 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液中n(OH-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 纤维编号 | ① | ② | ③ |
| 灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
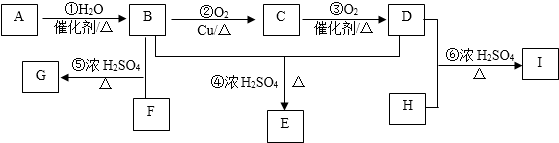
 .
.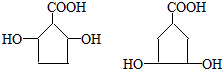 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据水溶液能否导电将化合物分为电解质和非电解质 | |
| B. | 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| D. | 根据能否与碱溶液反应,可将氧化物分为酸性氧化物和碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com