
【题目】下列有关酶的叙述错误的是( )
A.绝大多数酶是具有催化作用的蛋白质
B.酶的催化作用具有选择性和专一性
C.高温会使酶失去活性
D.酶只有在强酸性或强碱性条件下才能发挥作用
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
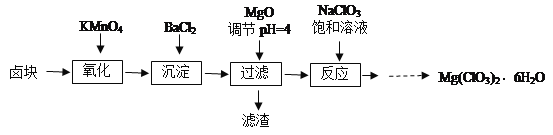
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S )随温度(T )变化曲线如图所示。
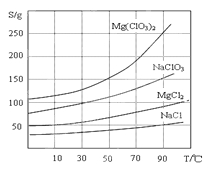
回答下列问题:
(1)调pH时,加入MgO的原因___________。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?____________。
(3)加入NaClO3饱和溶液后发生反应的类型为_____________________________,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:蒸发浓缩、①______;②_____;③过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量4.00 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和30 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液30.00 mL。
①滴定时应用_____________(“酸式”或“碱式”)滴定管。步骤2中发生反应的离子方程式:_____________________________。
②产品中Mg(ClO3)2·6H2O的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素存在多种硫化物,兴趣小组为测定某铁硫化物(FeaSy)的组成按下列流程进行探究:
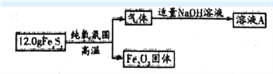
回答下列问题:
(1)测得Fe2O3固体的质量为8.0g,则FeaSy的化学式为______________。请设计实验检验Fe2O3中含有+3价铁:__________________________。
(2)铁硫化物在纯氧中发生反应的化学方程式为______________________________。
(3)兴趣小组同学推测溶液A中除含有Na2SO3外,还可能含有Na2SO4。设计实验方案并探究:
①用0.10 mol·L-1酸性KMnO4溶液应盛装在_______________(填“酸式“或“碱式”)滴定管中,然后进行滴定,反应的离子方程式为_________________________。
②确认A溶液中是否含有Na2SO4

请用化学方程式解释该方案不合理的原因____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物广泛用于蓄电池、机械制造、电缆护防等行业。
(1)用PbS熔炼铅的过程中会有如下反应发生:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=a kJ·mol-1
PbS(s) +2O2(g) =PbSO4(s) △H=b kJ·mol-1
PbS(s) +2PbO(s) =3Pb(s) +SO2(g) △H=c kJ·mol-1
写出PbS与PbSO4反应生成Pb和SO2的热化学方程式____________________。
(2)利用电解法也可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb,装置如下图所示。

a电极的名称是__________,b电极的电极反应式为______________________,该生产过程中可以循环利用的物质是____________________。
(3)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下:Pb+PbO2+2H2SO4![]() 2PbSO4 +2H2O。铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
2PbSO4 +2H2O。铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
(4)PbO2受热会随温度升高逐步分解。称取23.9g PbO2,将其加热分解,受热分解过程中固体质量随温度的变化如下图所示。

A点与C点对应物质的化学式分别为____________、_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种有机物的结构简式为R—CH=CH—COOH,式中的R为烷基,下列关于这种有机物的叙述中,错误的是 ( )
A. 若能溶于水,其水溶液与镁反应能放出氢气
B. 可以使溴水和酸性高锰酸钾溶液褪色
C. 可以与乙醇在一定条件下发生酯化反应
D. 不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦因发现青蒿素(化学式是C15H22O5)而获得2015年诺贝尔奖.青蒿素属于( )
A. 有机物 B. 氧化物 C. 碱 D. 盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为中学化学中常见的物质:①Cu; ②1molL﹣1的FeCl3溶液; ③CuCl2溶液;④CO2;⑤H2SO4;⑥酒精;⑦CaCO3;⑧FeSO4
(1)以上物质中属于电解质的是;属于混合物的是 .
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入②的溶液,至液体呈透明的红褐色氢氧化铁胶体.则反应的化学方程式为;氢氧化铁胶体中分散质微粒的直径范围为nm;判断该胶体制备是否成功的方法是 .
(3)将②③⑧混合配制成浓度均为1molL﹣1的混合溶液100mL,加入一定量的铁粉,充分反应后,若铁粉无剩余,且有铜生成.则反应后的溶液中一定含有阳离子,可能含有阳离子,该阳离子在溶液中物质的量可能的存在范围是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下。

根据上述情况,回答下列问题:
(1)上述五种金属的活动性顺序是______________。
(2)在①中,Cu片上观察到的现象是_____________________。
(3)在②中,溶液中H+向金属片______________移动。
(4)在④中,两金属片上均无气泡放出。此时两金属片上的电极反应式分别为Cu:_____________________;B:____________________________。
(5)如果实验⑤用B、D,则导线中电流方向为_______(填“B→D”或“D→B”)。
(6)已知反应:Cu+2Fe3+Cu2++2Fe2+。请用下列试剂和材料,用如图所示装置,将此反应设计成原电池。
试剂:CuCl2溶液、FeCl3溶液、FeCl2溶液、双氧水、NaOH溶液
材料:Cu片、Fe片、石墨棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com