
| A. | 酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的 | |
| B. | 饱和氯水既有酸性又有漂白性,加入NaHCO₃后漂白性减弱 | |
| C. | 烧融烧碱应选用的器皿是铁坩埚而不是石英坩埚、普通玻璃坩埚或陶瓷坩埚 | |
| D. | 用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵都会产生温室气体 |
分析 A.酸雨就是pH<5.6的雨水;
B.氯水中氯气和水反应生成盐酸和次氯酸,加入碳酸氢钠和盐酸反应,和次氯酸不反应;
C.能熔融氢氧化钠的器皿所含物质不与氢氧化钠反应,否则会导致器皿炸裂;
D.用氨制碳酸铵是利用了二氧化碳.
解答 解:A.正常雨水中因为溶有二氧化碳,故pH=5.6,酸雨就是pH<5.6的雨水,不是pH<7,故A错误;
B.氯水中氯气和水反应生成盐酸和次氯酸,加入碳酸氢钠和盐酸反应,和次氯酸不反应,漂白性不减弱,故B错误;
C.陶瓷坩埚、石英坩埚以及普通玻璃坩埚中都含有二氧化硅,在高温下都能与氢氧化钠反应而使坩埚炸裂,不能用于熔融氢氧化钠固体,只能用生铁坩埚,故C正确;
D.用纯碱制玻璃、用铁矿石炼铁都会产生温室气体,但用氨气和二氧化碳、水制取硫酸铵是利用二氧化碳,不是产生二氧化碳,故D错误.
故选C.
点评 本题主要考查的是酸雨、常见物质的性质、环境污染等,题目难度不大,学习中注意相关基础知识的积累.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
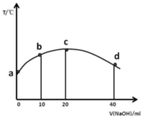 若往20ml 0.01mol/LCH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测的溶液的温度变化如图所示,下列有关说法正确的是( )
若往20ml 0.01mol/LCH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测的溶液的温度变化如图所示,下列有关说法正确的是( )| A. | c点时,醋酸的电离程度和电离常数都最大,溶液呈中性 | |
| B. | 若b点混合溶液显酸性,则2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 混合溶液中水的电离程度:b>c>d | |
| D. | 由图可知,该反应的中和热先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2B、NaHB两溶液中,离子种类不相同 | |
| B. | 二元酸H2B为强酸 | |
| C. | 在NaHB溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-) | |
| D. | 在Na2B溶液中一定有:c(Na+)>c(B2-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7的溶液是酸的溶液 | |
| B. | pH>7的溶液是碱的溶液 | |
| C. | pH>7的溶液有可能是盐的溶液,这是因为盐可能电离出H+ | |
| D. | pH>7的溶液有可能是盐的溶液,这是盐类水解造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn与稀硫酸反应放出氢气 | B. | 酸碱中和反应 | ||
| C. | 硫在空气中燃烧 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a气体 | b溶液 | 预测的现象 | |
| ① | C02 | BaCl2溶液 | 白色沉淀析出 |
| ② | SO2 | Ba(NO3)2 溶液 | 白色沉淀析出 |
| ③ | Br2 | AgNO3溶液 | 淡黄色沉淀析出 |
| ④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不需要加热就能发生的反应一定是放热反应 | |
| B. | HF、Ca(OH)2、BaSO4都是强电解质 | |
| C. | Na2O2溶于水,生成NaOH,其水溶液能导电,故Na2O2不是电解质 | |
| D. | 升高温度,可同时提高活化分子百分数和活化分子浓度,使化学反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com