
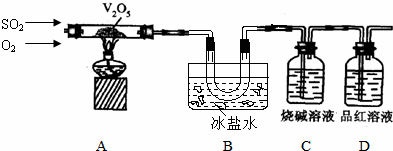
 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列问题: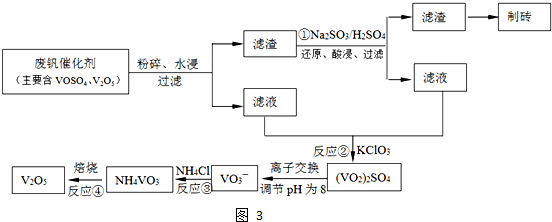
分析 (1)煅烧黄铁矿形成的炉气主要是二氧化硫气体,进入接触室前必须对气体继续除尘、洗涤、干燥,防止催化剂中毒,影响催化氧化的效果;
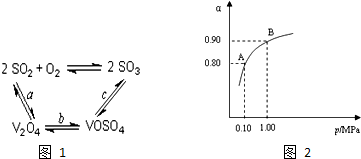
(2)根据催化剂参与反应过程生成的中间产物,分析催化剂参与反应,最终重新生成来书写化学方程式;
(3)压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压;
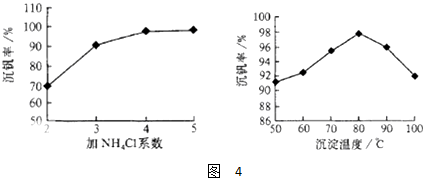
(4)根据流程中钒元素的存在化合物中的化合价的变化,判断出发生氧化还原反应的是①②;反应①是利用亚硫酸钠在酸性溶液中的还原性把难溶的V2O5转化为易溶于水的VOSO4便于钒的提取;根据图1和图2分析坐标系中的表示含义,结合图②中的沉矾率在80度C时最大,约为98%,在图①中找到对应沉矾率98%下的控制氯化铵系数为4.
解答 解:(1)以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收;其中二氧化硫的催化氧化在催化剂表面和空气中的氧气接触反应,若气体中含有杂质气体容易使催化剂中毒,所以煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥,故答案为:接触室,防止催化剂中毒;
(2)依据图1中的转化关系,V2O5参与反应先做氧化剂把二氧化硫氧化为三氧化硫,本身被还原为图中产物V2O4;根据氧化还原反应的实质写出并配平a步化学方程式SO2+V2O5?SO3+V2O4;C是VOSO4转化为SO3,此过程需要重新生成催化剂V2O5,需要氧化剂完成,此过程中的氧化剂时氧气,根据化合价的变化写出C步化学方程式 4VOSO4+O2?2V2O5+4SO3,故答案为:SO2+V2O5?SO3+V2O4;4VOSO4+O2?2V2O5+4SO3 ;
(3)从图象中可以看出,常压SO2就可以达到较高的转化率,压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压,故答案为:使用常压SO2就可以达到较高的转化率;
(4)依据离子交换法回收钒的新工艺流程图分析反应过程中:
①的目的是把难溶的五氧化二钒还原为溶于水的VOSO4;
②的目的是用KClO3还原为VOSO4为(VO2)2SO4;
③因为NH4VO3难溶于水,此步骤的目的是沉淀VO3-
④是分解NH4VO3得到V2O5;
工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据图示分析数据,80℃时沉矾率最高为98%,所以加NH4Cl的系数从图中读出为4,故答案为:①②;V2O5+SO32-+4H+=2VO2++SO42-+2H2O;4和80℃.
点评 本题考查了工业制硫酸的生产步骤、原理应用、注意问题,化学平衡的应用和条件选择,利用信息进行判断和书写化学方程式的能力,图象分析能力,提取钒元素的流程分析和氧化还原反应的应用.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气分子的电子式: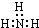 | B. | S2-的结构示意图: | ||
| C. | CH4的球棍模型示意图为: | D. | 用电子式表示HCl形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3与氢碘酸溶液反应Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 电解MgCl2溶液Mg2++2H2O+2Cl-═Mg(OH)2↓+Cl2↑+H2 | |
| C. | Zn与氯化铵溶液反应生成气体Zn+2NH4+═Zn2++4H2↑+N2↑ | |
| D. | 向明矾的水溶液中滴加足量Ba(OH)2溶液Al3++SO42-+Ba2++4OH-═AlO2-+BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
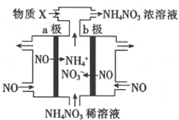 电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )
电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )| A. | a极接电源的负极 | |
| B. | 阳极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| C. | 阴极反应为:NO+5e-+6H+=NH4++H2O | |
| D. | X为NH3最终制得3molNH4NO3理论上需补充2molX物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向溶液中滴加BaCl2溶液,再加入盐酸 | 产生白色沉淀不溶解 | 原溶液中有SO42- |
| B | 将黄豆粒大的钠放入CuSO4稀溶液中 | 产生红色固体 | 金属性:Na>Cu |
| C | 向1mL20%的蔗糖溶液中加入几滴稀硫酸,水浴加热后取少量NaOH溶液,再加入新制的Cu(OH)2,加热 | 产生砖红色沉淀 | 蔗糖水解产生葡萄糖 |
| D | 向盛有少量Na2O2固体的试管中加入一定量的蒸馏水,再滴加酚酞试液 | 溶液变红后褪色 | 说明可能生成了H2O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
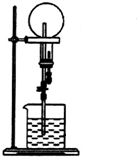
| A. | 若烧瓶的氨气中混有少量氮气,则喷泉实验后的水不能充满烧瓶 | |
| B. | 本实验之所以能够产生喷泉是因为氨气极易溶于水,导致烧瓶内外存在压强差 | |
| C. | 本实验若将NH3换成Cl2,烧杯中水换成饱和食盐水,也能产生喷泉 | |
| D. | 实验结束后烧瓶中氨水的物质的量浓度为$\frac{1}{22.4}$ mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com