
下列实验基本操作(或实验注意事项)中,主要是处于实验安全考虑的是
A.实验剩余的药品不能放回原试剂瓶
B.可燃性气体的验纯
C.气体实验装置在实验前进行气密性检查
D.滴管不能交叉使用
科目:高中化学 来源:2016届河北省保定市高三上学期摸底考试化学试卷(解析版) 题型:选择题
在l00mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5. lg。则下列叙述不正确是
A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况)
B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为l00mL
C.原稀硝酸的物质的量浓度一定为4 mol/L
D.参加反应金属总质量( m)为9.6g>m>3. 6g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省清远市高二上学期10月月考化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.在稀溶液中,1mol酸和1mol碱完全反应所放出的热量叫做中和热
B.在101kPa时1mol物质燃烧时的反应热叫做该物质的燃烧热
C.热化学方程式中,各物质前的化学计量数不表示分子个数
D.如果反应物所具有的总能量低于生成物所具有的总能量,则发生的反应是放热反应
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期10月月考化学试卷(解析版) 题型:选择题
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+物质的量分别

A. 2 mol、3 mol、6 mol B. 3 mol、2 mol、6mol
C. 2 mol、3 mol、4 mol D. 3 mol、2 mol、2 mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一上学期第一次月考化学试卷(解析版) 题型:选择题
有一真空瓶质量为m1,该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3。则A的相对分子质量是
A.29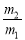 B.29
B.29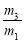 C.29
C.29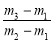 D.29
D.29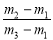
查看答案和解析>>
科目:高中化学 来源:2016届河南省英文学校高三上学期期中测试化学试卷(解析版) 题型:实验题
(14分)某校化学实验兴趣小组在“探究卤索单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入l~2滴溴水,振荡后溶液呈黄色。
提出问题 Fe3+、Br2谁的氧化性更强?
(1)猜 想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含 所致。
(2)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液;b.CCl4;c.无水酒精;d.KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
选用试剂 | 实验现象 | |
方案1 | ||
方案2 |
(3)结论:氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入l~2滴溴水,溶液呈黄色所发生的离子反应方程式为 。
(4)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是: (填离子的化学式)。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省绥化市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列物质与其用途完全符合的有
①Na2CO3—制玻璃;②SiO2—太阳能电池;③AgI—人工降雨;
④NaCl—制纯碱;⑤Al2O3—焊接钢轨;⑥NaClO—消毒剂、漂白织物
⑦Fe2O3—红色油漆或涂料⑧MgO—耐火材料
A.4个 B.5个 C.6个 D.7个
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列反应不属于取代反应的是
A.淀粉水解制葡萄糖
B.石油裂解制丙烯
C.乙醇与乙酸反应制乙酸乙酯
D.油脂与浓NaOH反应制高级脂肪酸钠
查看答案和解析>>
科目:高中化学 来源:2016届安徽省皖南八校高三上学期第一次联考化学试卷(解析版) 题型:填空题
卤族元素是典型的非金属元素,卤素单质及其化合物在工农业生产和生活中都有重要的用途。
(1)同主族元素的电负性大小存在一定的规律,卤族元素(F、Cl、Br、I)中,电负性最大的是 。
(2)不同卤素原子之间可形成卤素互化物,如IBr、BrI3、BrF5、IF,等。卤素互化物中的化学键类型是 (填标号)。
A.极性键 B.非极性键 C.离子键 D.σ键
(3)BeCl2的分子空间构型为__________;BF3分子中B-F键的键角为_____________。
(4)CCl4分子中的C原子和NF3分子中的N原子的杂化方式是否相同? 。如果相同,则其杂化方式为 ;如果不相同,则其杂化方式分别为 。(后两个空只能填一个,若两空都填,则不给分)
(5)HF的相对分子质量小于HC1,但其沸点却高于HC1,其原因是________________
(6)由F、Mg、K三种元素形成的某种晶体的晶胞结构如下图所示,晶胞边长为anm,该晶体的化学式为_________________________;列式计算该晶体的密度(g.cm-3)
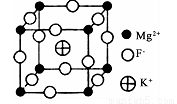
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com