

| A. | 若X是盐桥,则电子由B电极经外电路流向A电极 | |
| B. | 若X是铜条,则A电极的电极反应式是:Zn2++2e-═Zn | |
| C. | 若X是石墨条,则乙池溶液的PH不变 | |
| D. | 若X 是锌条,则A电极的质量会减小 |
分析 A.若X是盐桥,则该装置是原电池,Zn是负极、Cu是正极,电子从负极流向正极;
B.若X是铜条,左边甲形成原电池,金属锌被腐蚀;
C.若X是石墨条,甲为原电池,锌是负极,乙为电解池,B是阴极,电解硫酸铜;
D.若X是锌条,右边乙形成原电池,Cu为正极,甲为电解池,Zn为阳极,发生氧化反应.
解答 解:A.若X是盐桥,则该装置是原电池,Zn是负极、Cu是正极,电子从负极A(锌)沿导线流向正极B(铜),故A错误;
B.若X是铜条,左边甲形成原电池,金属锌是负极,Cu是正极,右边形成电解池,A电极的电极反应式是Zn-2e-═Zn2+,故B正确;
C.若X是石墨条,甲为原电池,锌是负极,乙为电解池,B是阴极,电解硫酸铜,电解硫酸铜会产生硫酸,则乙池溶液的pH会减小,故C错误;
D.若X是锌条,右边乙形成原电池,Cu为正极,甲为电解池,Zn为阳极,发生氧化反应,Zn为阳极,发生氧化反应,质量会减小,故D正确;
故选BD.
点评 本题考查了原电池原理,明确盐桥的作用是解本题关键,将盐桥变为其它金属或导电的非金属不能构成原电池,再结合是否能自发进行氧化还原反应分析解答,题目难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:填空题
 氧化氢溶掖的试管内加入肝或沙子.在这个实验中,试管A放氧相对缓慢,试管C和D不放氧.请问答下列问题:
氧化氢溶掖的试管内加入肝或沙子.在这个实验中,试管A放氧相对缓慢,试管C和D不放氧.请问答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
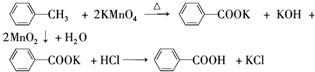
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
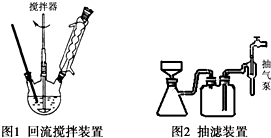
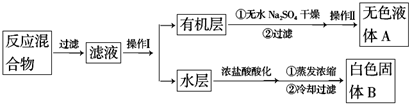
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:1 | C. | 1:1:2 | D. | 4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上制取粗硅的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| B. | 硫酸型酸雨的形成会涉及反应2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| C. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+═SO2+S↓+H2O | |
| D. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2: 2ClO-+CO2+H2O=2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
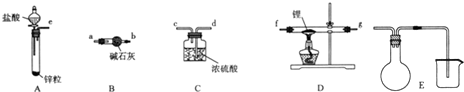
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com