
分析 根据原子守恒得n(Cu)=n(CuSO4)=0.3mol,电解时阴极上Cu 2+先析出,然后H+放电生成H2,阴极生成n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,阴极转移电子物质的量=2(Cu)+2n(H2)=0.3mol×2+0.1mol×2=0.8mol,阳极上先Cl-放电,Cl-完全放电转移电子物质的量=0.4mol×1=0.4mol<0.8mol,则阳极上还生成O2,根据转移电子守恒计算生成氧气物质的量,据此分析解答.
解答 解:根据原子守恒得n(Cu)=n(CuSO4)=0.3mol,电解时阴极上Cu 2+先析出,然后H+放电生成H2,阴极生成n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,阴极转移电子物质的量=2(Cu)+2n(H2)=0.3mol×2+0.1mol×2=0.8mol,阳极上先Cl-放电,Cl-完全放电转移电子物质的量=0.4mol×1=0.4mol<0.8mol,则阳极上还生成O2,根据Cl原子守恒得n(Cl2)=$\frac{1}{2}$n(NaCl)=$\frac{1}{2}$×0.4mol=0.2mol,n(O2)=$\frac{0.8mol-0.4mol}{4}$=0.1mol,
答:另一电极上先后析出的气体的成分是Cl2和O2,其物质的量分别是0.2mol、0.1mol.
点评 本题以电解原理为载体考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,正确判断各个电极上发生的反应是解本题关键,阴阳极上转移电子守恒,根据转移电子守恒计算即可,题目难度不大.


科目:高中化学 来源: 题型:选择题
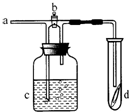 如图所示,从a处通入了氯气.若打开活塞b,d处的干燥有色布条不褪色,若关闭活塞b,d处的干燥有色布条褪色.下列判断正确的是( )
如图所示,从a处通入了氯气.若打开活塞b,d处的干燥有色布条不褪色,若关闭活塞b,d处的干燥有色布条褪色.下列判断正确的是( )| A. | c中盛放的不可能是NaCl溶液 | B. | c中盛放的可能是浓硫酸 | ||
| C. | c中盛放的可能是足量NaOH溶液 | D. | a处通入的是干燥的氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2═H2O | B. | NH3+HCl═NH4Cl | ||
| C. | 4Fe(OH)2+2H2O+O2═4Fe(OH)3 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能自发进行的氧化还原反应,通过电解的原理可以实现 | |
| B. | 电镀时保持电流恒定,升高温度不改变电解反应速率 | |
| C. | 电解精炼铜电解槽底部会形成含少量Ag、Fe、Pt等金属的阳极泥 | |
| D. | 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 | |
| E. | MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液,若电解电路中通过2mol电子,MnO2的理论产量为1mol | |
| F. | 燃料电池是将燃料燃烧所放出的能量转化为化学能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+X2═2HX | B. | X2+H20═HX+HXO | ||
| C. | NaX+AgNO3═AgX↓+NaNO3 | D. | 2NaX+H2SO4(浓)═Na2SO4+2HX |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
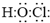 .二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠(NaClO3)和另一种氯的含氯酸盐,同时生成水,该反应的离子方程式为2ClO2+2OH-═ClO3-+ClO2-+H2O
.二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠(NaClO3)和另一种氯的含氯酸盐,同时生成水,该反应的离子方程式为2ClO2+2OH-═ClO3-+ClO2-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:H2SO3?HSO${\;}_{3}^{-}$+H+ Ka1、HSO${\;}_{3}^{-}$?SO${\;}_{3}^{2-}$+H+ Ka2
已知:H2SO3?HSO${\;}_{3}^{-}$+H+ Ka1、HSO${\;}_{3}^{-}$?SO${\;}_{3}^{2-}$+H+ Ka2| A. | 曲线3表示的微粒是SO32- | |
| B. | 溶液pH=4.2时,c(Na+)+c(H+)=c(OH-)+2c(SO32-) | |
| C. | 常温下,$\frac{{K}_{a1}}{{K}_{a2}}$=1000 | |
| D. | 溶液pH=1.2时:c(Na+)+c(H+)=c(OH-)+c(HSO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com