
����������������۷���Ϣ���ʵijɷ�֮һ�������㽶����ζ��ʵ�����Ʊ������������ķ�Ӧװ��ʾ��ͼ���й��������£�

ʵ�鲽�裺
��A�м���4.4 g�����촼��6.0 g�����ᡢ����Ũ�����2��3Ƭ���Ƭ����ʼ��������A������50���ӣ���ӦҺ�������º����Һ©���У��ֱ�������ˮ������̼��������Һ��ˮϴ�ӣ��ֳ��IJ������������ˮ����þ���壬����Ƭ�̣����˳�ȥ����þ���壬�������������ռ�140��143 ����֣�������������3.9 g���ش��������⣺
��1��װ��B�������ǣ�
��2����ϴ�Ӳ����У���һ��ˮϴ����ҪĿ���ǣ� �� �ڶ���ˮϴ����ҪĿ���ǣ� ��
��3����ϴ�ӡ���Һ�����У�Ӧ�����Ȼ���ã����ֲ�� �����ţ���
A��ֱ�ӽ������������ӷ�Һ©���Ͽڵ���
B��ֱ�ӽ������������ӷ�Һ©���¿ڷų�
C���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ��������������¿ڷų�
D���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ��������������Ͽڷų�
��4����ʵ���м�����������Ŀ���ǣ�
��5��ʵ���м���������ˮ����þ��Ŀ���ǣ�
��6������������У�����ѡ��װ����ȷ���ǣ� (����)

��7����ʵ��IJ����ǣ�
A��30℅ B��40℅ C��50℅ D��60℅
��8���ڽ����������ʱ������130 �濪ʼ�ռ���֣�����ƫ (����ߵ�)ԭ����
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���н�����ʹ�����������õ�ҩ��ұصá���Ҫ�ɷֵĽṹ��ʽ���£� �������� �� ��
�ٷ����廯�����֬���廯������л�������л��߷��ӣ��ݷ�����
A���ۢ� B���ڢ� C���٢� D�� �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ҫ����գ�
��1��2-��-1-��ϩ�Ľṹ��ʽ�� ��
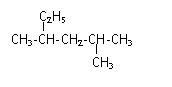 ��2��
��2��
�����ƣ� ��
��3�� HOCH2CH2CH2CH2OH�����ƣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�ֽ�1 mol H2O2 �ų�����98KJ���ں�����I������Һ�У�H2O2�ķֽ����Ϊ��
H2O2�� I�� ��H2O ��IO�� �� H2O2�� IO����H2O ��O2�� I�� ��
�����йط�Ӧ��˵����ȷ����( )
A����Ӧ��������I����Ũ���й� B�� IO��Ҳ�Ǹ÷�Ӧ�Ĵ���
C����Ӧ��ܵ���98KJ·mol��1 D��v(H2O2)=v(H2O)=v(O2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ѧ—ѡ��5���л���ѧ������(15��)
ϯ��������G�ڴ���ҩ��²��ϵȷ����й㷺Ӧ�á��ϳ�G��һ��·�����£�
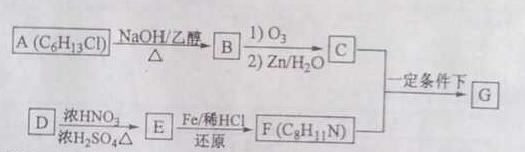
��֪������Ϣ��
��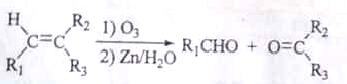
��һĦ��B��������Ӧ�����Ӷ�Ħ��C����C���ܷ���������Ӧ��
��D���ڵ�ȡ������������Է�������Ϊ106��
�ܺ˴Ź���������ʾF�����������ֻ�ѧ������
��
�ش��������⣺
��1����A����B�Ļ�ѧ����ʽΪ ����Ӧ����Ϊ
��2��D�Ļ�ѧ������ ����D����E�Ļ�ѧ����ʽΪ��
��3��G�Ľṹ��ʽΪ
��4��F��ͬ���칹���к��б����Ļ���____�֣������������칹�������к˴Ź�����������4��壬�������Ϊ6��2��2��1����_______����д�����е�һ�ֵĽṹ��ʽ����
��5���ɱ��ͻ�����C�����²���ɺϳ�N-�����������
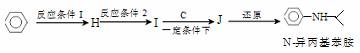
��Ӧ����1��ѡ����Լ�Ϊ____________����Ӧ����2��ѡ����Լ�Ϊ________��I�Ľṹ��ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�������£�N2O�ֽ�IJ���ʵ���������£�

��ͼ����ȷ��ʾ�÷�Ӧ�й��������仯���ɵ���
(ע��ͼ�а�˥��ָ��һŨ��N2O����һ��ʱ�������Ӧʱ�䣬c1��c2����ʾN2O��ʼŨ����c1��c2)
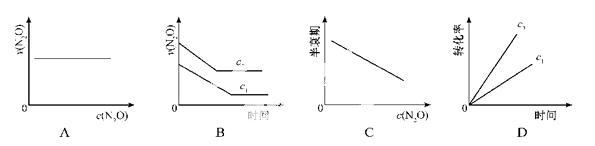
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ڷ�Ӧ����ش���������:
(1)��1L1mol/L��NaOH��Һ�м����������ʣ���ŨH2SO4����ϡ�����ϡ���ᣬǡ����ȫ��Ӧ����ЧӦΪ��H1����H2����H3����������С����˳��Ϊ ��
(2) ʵ���ã���200mL1mol/L��NaOH��Һ�м���ϡ����ǡ�÷�Ӧ�ų�Q kJ����������д���Ȼ�ѧ��Ӧ����ʽ��_________________________ ��
(3)��֪��ӦCH3��CH3(g)�D��CH2=CH2(g)��H2(g)���йػ�ѧ���ļ������¡�
| ��ѧ�� | C��H | C=C | C��C | H��H |
| ����/kJ��mol��1 | 414.4 | 615.3 | 347.4 | 435.3 |
�Լ���÷�Ӧ�ķ�Ӧ��___________________________
��4������N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺��֪��N2(g)+O2(g) = 2NO(g) ��H=+180��5kJ/mol
N2(g)+3H2(g)  2NH3(g) ��H=��92��4kJ/mol
2NH3(g) ��H=��92��4kJ/mol
2H2(g)+O2(g) = 2H2O(g) ��H=��483��6kJ/mol
д����������������ȫ����һ�����������ˮ�������Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com