
科目:高中化学 来源: 题型:
| A、2012 年环保热词“PM2.5”是指大气中直径小于或等于2.5 微米(1 微米=1×10-6 米)的颗粒,“PM2.5”与空气形成的分散系属于胶体 |
| B、石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 |
| C、任何元素的原子都是由核外电子和核内中子、质子组成的 |
| D、分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
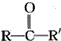 (R、R’代表烷基或H原子)发生缩合反应生成新的有机物和水.苯酚还能发生如图1反应生成有机酸酯:
(R、R’代表烷基或H原子)发生缩合反应生成新的有机物和水.苯酚还能发生如图1反应生成有机酸酯:

 反应合成聚碳酸酯的化学方程式
反应合成聚碳酸酯的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向稀硝酸中加入铁粉 |
| B、向氯化铝溶液中加入过量的氨水 |
| C、向NaOH溶液中通入CO2气体 |
| D、向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O2 |
| B、向Na2CO3溶液中滴加HCl溶液,立即有气体产生CO32-+2H+═H2O+CO2↑ |
| C、Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物2Na2O2+2CO2═2Na2CO3+O2 |
| D、向NaHCO3溶液中逐滴加入澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
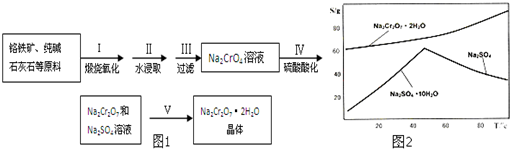
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com