
| A. | 尽管氯气的化学性质很活泼,但是纯净的液氯能用钢瓶贮存 | |
| B. | 欲除去CO2中的大量HCl气体,可将此混合气体通过盛有饱和NaHCO3溶液的洗气瓶 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存 | |
| D. | 新制的氯水中加入AgNO3溶液,有白色沉淀生成 |
分析 A.干燥的氯气与Fe不反应;
B.二氧化碳和碳酸氢钠溶液不反应,氯化氢极易溶于水;
C.漂白粉的有效成分是次氯酸钙,漂白粉中含有Ca(ClO)2,易与空气中的水和二氧化碳反应生成不稳定的HClO而变质'
D.新制氯水中氯气和水反应生成盐酸和次氯酸,溶液中氯离子结合银离子生成氯化银沉淀.
解答 解:A.干燥的氯气与Fe不反应,则干燥的液氯能用钢瓶贮存,故A正确;
B.欲除去CO2中的大量HCl气体,二氧化碳和碳酸氢钠溶液不反应,氯化氢极易溶于水,可将此混合气体通过盛有饱和NaHCO3溶液的洗气瓶可以洗去氯化氢,起到除杂作用,故B正确;
C.漂白粉的主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙,漂白粉中含有Ca(ClO)2,易与空气中的水和二氧化碳反应生成不稳定的HClO而变质,应密封保存,故C错误;
D.新制的氯水中氯气和水发生反应,Cl2+H2O?HCl+HClO,加入AgNO3溶液,HCl+AgNO3=AgCl↓+HNO3,有白色沉淀生成,故D正确;
故选C.
点评 本题考查氯气、氯水以及漂白粉的组成和性质,题目难度不大,本题注意把握新制氯水的性质,变价金属和强氧化剂反应生成高价金属的盐.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水形成氯水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 将FeO溶解于足量稀HNO3中:FeO+2H+═Fe2++H2O | |
| C. | 硫酸铝溶液中滴加过量浓氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | SO2用过量NaOH溶液吸收:SO2+2OH-═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
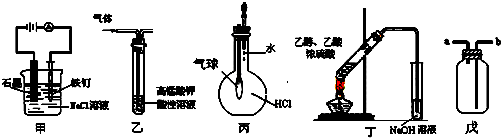
| A. | ①③⑤ | B. | ③⑤ | C. | ①②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
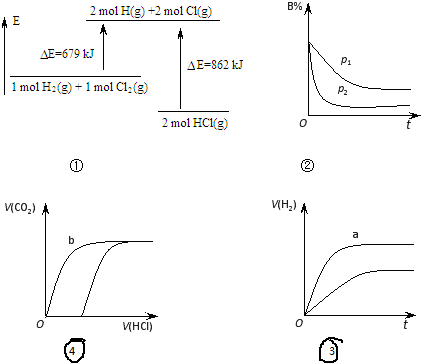
| A. | ①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183 kJ/mol | |
| B. | ②表示其它条件不变时,反应 4A(g)+3B(g)?2C(g)+6D在不同压强下 B的体积分数随时间的变化,则D一定是气体 | |
| C. | ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a曲线表示CH3COOH溶液 | |
| D. | ④表示分别向同为10 mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,逐滴滴加0.1mol/L 盐酸,所产生CO2的体积随盐酸体积的变化情况,则b曲线表示Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入二氧化碳气体 | B. | 加水稀释 | ||
| C. | 通入氯化氢气体 | D. | 加入饱和石灰水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液的水解:S2-+2H2O?H2S+2OH- | |
| B. | NaHCO3溶液的电离:HCO3-+H2O?H2 CO3+OH- | |
| C. | NH4Cl溶液的水解:NH4++H2O?NH3•H2O+H+ | |
| D. | 泡沫灭火器灭火原理:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②③④ | C. | ①②③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 碱 | 盐 | 氧化物 | |
| A | 硫 酸 | 纯 碱 | 硅酸钠 | 铁 红 |
| B | 氢硫酸 | 烧 碱 | 纯 碱 | 生石灰 |
| C | 碳 酸 | 石 膏 | 小苏打 | 二氧化硫 |
| D | 二氧化碳 | 苛性钠 | 食 盐 | 石灰石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
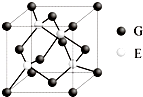 现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小;B的原子有6个运动状态不同的电子;D、E两元素同主族,且E的原子核外电子数是D的2倍;F是前四周期中未成对电子数最多的元素;G原子内层轨道全排满电子,最外层电子数为2.根据以上信息,回答下列问题:
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小;B的原子有6个运动状态不同的电子;D、E两元素同主族,且E的原子核外电子数是D的2倍;F是前四周期中未成对电子数最多的元素;G原子内层轨道全排满电子,最外层电子数为2.根据以上信息,回答下列问题: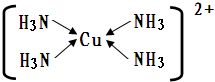 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com