
分析 (1)根据溶度积常数确定先沉淀的物质,溶度积常数越小的物质越先沉淀,铜离子和氨水反应生成氢氧化铜和铵根离子;
(2)根据电荷守恒判断铵根离子浓度和氯离子浓度相对大小;
(3)由N2H4与N2的热化学方程式,运用盖斯定律,可知肼与二氧化氮反应的热化学方程式;
(4)酸性氢氧燃料电池在正极上放电的是氧气,电极反应是:O2+4e-+4H+=2H2O;碱式氢氧燃料电池在负极放电的是氢气,负极反应式为H2-2e-+2OH-=2H2O.
解答 解:(1)25℃时,Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20,氢氧化铜的溶度积常数小于氢氧化镁的溶度积常数,
所以在25℃下,向浓度均为0.1 mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成氢氧化铜沉淀;反应的化学方程式是:CuCl2+2NH3•H2O=Cu(OH)2↓+2NH4Cl,NH3•H2O是弱碱,不能拆,Cu(OH)2是弱碱不能拆,故反应的离子方程式为:Cu2++2NH3•H2O?Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O?Cu(OH)2↓+2NH4+;
(2)溶液中存在电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,
故答案为:中性;
(3)根据盖斯定律,将(2×①)+(2×②)可知:
肼与二氧化氮反应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g )△H=-1135.7kJ/mol
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g )△H=-1135.7kJ/mol;
(4)氢氧燃料电池无论是酸式还是碱式,其电池总反应均为:2H2+O2=2H2O ①
酸式氢氧燃料电池负极电极反应式为:2H2-4e-=4H+②
用(①-②)即得酸式氢氧燃料电池的正极反应:O2+4e-+4H+=2H2O;
碱式氢氧燃料电池的正极电极反应式为:O2+2H2O+4e-=4OH-③
用(①-③)即得:2H2-4e-+4OH-=4H2O,故碱式氢氧燃料电池的负极反应:H2-2e-+2OH-=2H2O,
故答案为:O2+4e-+4H+=2H2O;H2-2e-+2OH-=2H2O.
点评 本题考查了难溶物溶度积的计算、盖斯定律在热化学方程式中的应用、原电池工作原理、酸碱混合的定性判断等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析能力及灵活应用基础知识的能力.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 向氨水中滴入稀硫酸:H++OH-═H2O | |
| B. | 向硫酸铝溶液中滴入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向饱和氨水中通过量的CO2气体:NH3+H2O+CO2═NH4++HCO3- | |
| D. | 向氯化铵的稀溶液中滴入少量的NaOH溶液:NH4++OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯中的少量溴:加入NaOH溶液,振荡、静置分层后,除去水层 | |
| B. | 除去乙酸乙酯中残留的乙醇:加入乙酸和浓硫酸,然后加热,再分液 | |
| C. | 将红热的铜丝迅速插入乙醇中,反复多次,可观察到铜丝表面变黑,并能闻到香味 | |
| D. | 向淀粉溶液中加入少量稀硫酸并加热,为测定其是否发生水解和是否完全水解,需使用到的试剂有碘水和新制Cu(OH)2悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
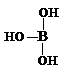 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: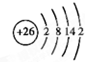 .
.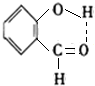 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H14 | B. | C7H16 | C. | C8H18 | D. | C9H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
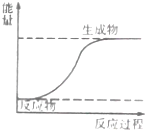
| A. | 如图表示化学反应过程中释放能量 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 化学反应中一定存在化学键的变化 | |
| D. | 原电池是将化学能转变成电能的装置 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com