
分析 (1)ClO2可将剧毒氰化物氧化成无毒气体氮气而除去,本身被还原为氯离子;
(2)①在酸性条件下,NaClO3和Na2SO3溶液混合反应生成ClO2、硫酸钠和水;
②由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体;
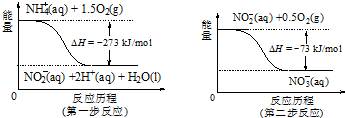
(3)由图可知第一步的热化学方程式为NH4+(aq)+1.5O2(g)═NO2-(aq)+2H+(aq)+H2O(l)△H=-273KJ/mol,
第二步的热化学方程式为:NO2-(aq)+0.5O2(g)═NO3-(aq)△H=-73KJ/mol,
结合盖斯定律可知,两使相加得到NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq).
解答 解:(1)ClO2可将剧毒氰化物氧化成无毒气体氮气而除去,本身被还原为氯离子,离子反应为2ClO2+2CN-=2CO2↑+N2↑+2Cl-,
故答案为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-;
(2)①在酸性条件下,NaClO3和Na2SO3溶液混合反应生成ClO2、硫酸钠和水,反应为2NaClO3+H2SO4+Na2SO3=2ClO2↑+2Na2SO4+H2O,
故答案为:2NaClO3+H2SO4+Na2SO3=2ClO2↑+2Na2SO4+H2O;
②A.ClO2易溶于水,不能利用饱和食盐水吸收氨气,故A错误;
B.碱石灰不能吸收氨气,故B错误;
C.浓硫酸可以吸收氨气,且不影响ClO2,故C正确;
D.ClO2易溶于水,不能利用水吸收氨气,故D错误.
故答案为:C;
(3)第一步的热化学方程式为NH4+(aq)+1.5O2(g)═NO2-(aq)+2H+(aq)+H2O(l)△H=-273KJ/mol,
第二步的热化学方程式为:NO2-(aq)+0.5O2(g)═NO3-(aq)△H=-73KJ/mol,
由盖斯定律,两个反应式相加得到NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-273KJ/mol+(-73KJ/mol)=-346 kJ/mol,
故答案为:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq)△H=-346 kJ/mol.
点评 本题考查较综合,涉及物质的性质、氧化还原反应及热化学反应方程式书写等,注重化学反应原理及分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
 .
. 、
、 .
.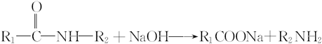
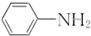 呈弱碱性,易被氧化
呈弱碱性,易被氧化 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体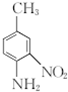 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: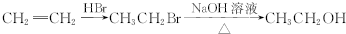
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+HCl | B. | Ag NO3+NaCl | C. | Fe+CuSO4 | D. | NaOH+H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
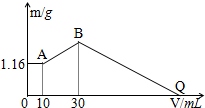 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可通过控制溶液的pH降低氨基酸的熔点,分离不同氨基酸 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| C. | 所有的糖类、油脂和蛋白质均能发生水解反应 | |
| D. | 利用二氧化碳制造全降解塑料能有效减少“白色污染” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com