
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)草酸是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是____________
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-) = 0.1 mol·L-1
C.c(C2O42-) < c(H2C2O4)
D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
(2)0.1 mol·L-1的NaHCO3溶液中存在的平衡有(用离子方程式表示)_____________。
(3)MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是
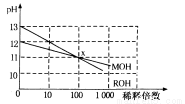
A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
(4)AgCl在溶液中存在如下平衡: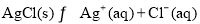 在25℃时,AgCl的
在25℃时,AgCl的
Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3
mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+
浓度由大到小的顺序为_____________(填序号),向50 mL 0.018 mol/L的AgNO3溶液中加
入50 mL 0.02 mol/L的盐酸,沉淀生成后溶液中c(Ag+)是________mol/L。如果向生成沉淀
后的溶液中再加入50 mL 0.001 mol/L的盐酸,是否产生沉淀_______(填“是”或“否”)。
(1)D
(2) 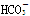
 H++
H++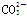 ;
;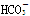 +H2O
+H2O H2CO3+OH-;H2O
H2CO3+OH-;H2O H++OH-
H++OH-
(3)D (4)②①③ 1.8×10-7 否
【解析】
试题分析:(1)A.溶液遵循电中性原则,则有c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故A错误;B.草酸氢钾溶液中存在H2C2O4、C2O42-、HC2O4-,根据物料守恒可知c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.1mol/L,故B错误;C.草酸氢钾溶液呈酸性,说明HC2O4-电离程度大于水解程度,则c(C2O42-)>c(H2C2O4),故C错误;D.在0.1mol?L-1KHC2O4溶液中,存在H2C2O4、C2O42-、HC2O4-和K+,根据物料守恒可知c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),故D正确。
(2)0.1 mol·L-1的NaHCO3溶液中存在的平衡有:HCO3?的水解平衡、电离平衡以及水的电离平衡,离子方程式为: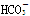
 H++
H++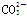 ;
;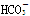 +H2O
+H2O H2CO3+OH-;H2O
H2CO3+OH-;H2O H++OH-
H++OH-
(3)A.由图可知,ROH的pH=13时稀释1000倍,pH变为10,则ROH为强碱,故A正确;B.由图可知,MOH的pH=12时稀释100倍,pH变为11,则MOH是弱碱,在x点不完全电离,故B正确;C.在X点,pH相同,则c(OH-)相同,由电荷守恒可知,c(M+)=c(R+),故C正确;D.ROH为强碱,稀释前浓度为0.1mol/L,MOH的pH=12时稀释100倍,pH变为11,则说明MOH为弱碱,稀释前MOH的浓度大于0.01mol/L,则稀释前c(ROH)<10c(MOH),故D错误。
(4)含有银离子或氯离子的溶液抑制AgCl溶解,氯离子或银离子浓度越大其抑制AgCl溶解程度越大,氯化镁和硝酸银溶液抑制AgCl溶解,但硝酸银是可溶性盐,所以硝酸银溶液中银离子浓度最大,则Ag+浓度由大到小的顺序为②①③;溶液混合后,不发生反应时c(Ag+)=1/2×0.018mol?L-1=0.009mol?L-1、c(Cl-)=1/2×0.02mol?L-1=0.01mol?L-1,令平衡时溶液中Ag+的浓度为xmol/L,则;
Ag+(aq)+Cl-(aq)?AgCl(s)
(0.009-x)mol/L (0.009-x)mol/L
反应后溶液中c(Cl-)=0.01mol/L-(0.009-x)mol/L=(0.001+x)mol/L,故x?(0.001+x)=1.8×10-10,由于0.009×0.01=9×10-5>1.8×10-10,故0.001+x≈0.001,解得x≈1.8×10-7;再向反应后的溶液中加入100mL0.001mol?L-1盐酸,不发生反应时c(Ag+)=1/2×1.8×10-7mol?L-1=9×10-8mol?L-1、c(Cl-)=1/2×[(0.001+1.8×10-7+0.001]mol?L-1≈0.001mol?L-1,而离子浓度积=0.001×9×10-8=0.9×10-10<1.8×10-10,故没有沉淀产生。
考点:本题考查盐类的水解、弱电解质的电离平衡、离子浓度比较、沉淀溶解平衡及计算。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2015届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:选择题
高纯度晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场 “革命”。它可以按下列方法制备:
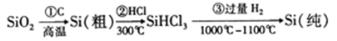
下列说法正确的是
A.步骤①的化学方程式为:SiO2+C Si+CO2↑
Si+CO2↑
B.步骤①②③中每生成或反应1mol Si,转移4mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列因果关系成立的是
A.因为维生素C受热易被氧化,所以有些新鲜蔬菜生吃较好
B.因为SO2可以使溴水褪色,所以SO2具有漂白性
C.因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH
D.因为NH3的水溶液可以导电,所以NH3是电解质
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三年级第二次月考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
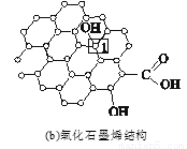
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示。
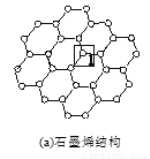
(1)基态碳原子的核外电子有_________种运动状态。
(2)图(a)中,1号C与相邻C形成σ键的个数为________。
(3)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(4)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
(5)石墨烯可转化为富勒烯分子(C60),C60属于________晶体,某金属M与C60可制备一种低温超导材料,晶胞如图所示,
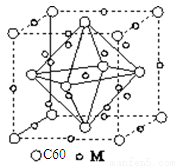
M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三年级第二次月考理综化学试卷(解析版) 题型:选择题
一定能在下列溶液中大量共存的离子组是
①含有大量Al3+的溶液中:Na+、NH4+、SO42-、Cl-
②加入Al能放出H2的溶液中:Cl-、CO32-、SO42-、NH4+
③含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN-
④在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+
⑤由水电离出的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3—
A.① B.①② C.①③⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期期中考试理科综合化学试卷(解析版) 题型:选择题
下列关系的表述中,正确的是
A.0.1mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(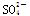 )+c(OH-)
)+c(OH-)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1
C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D.0.1mol·L-1NaHCO3溶液中:c(Na+)>c(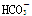 )>c(
)>c(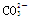 )>c(H2CO3)
)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:填空题
有关物质间有下图所示的转化关系。已知B、D、G是常见的金属单质,E为常见非金属单质,H常温下为无色液体,K为红棕色气体。
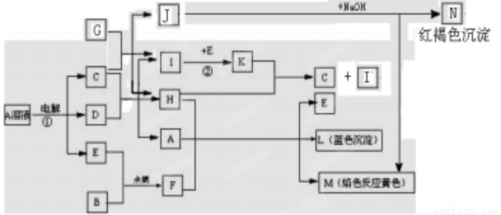
(1)F的电子式_____________,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目_____________________________________
(2)反应①的离子方程式_________________________________________.
(3)C与足量G反应的化学方程式_______________________________,其中,还原剂与氧化剂的物质的量之比______________________,检验反应中生成金属离子的方程式__________________________________
(4)Al能与A发生置换反应,生成物溶质与Na2CO3不能在溶液中共存,用离子方程式表示其原因:___________________________
(5)I可由某种氢化物催化氧化得到,其化学反应方程式为________________________
(6)漂白粉同F都应密封保存,写出漂白粉露置于空气中失效的化学反应方程式______________________、__________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列有关溶液的说法正确的是()
A.配置20g密度为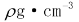 的Ca(NO3)2溶液中含有2gCa(NO3)2,则溶液中NO3-的物质的量浓度为25
的Ca(NO3)2溶液中含有2gCa(NO3)2,则溶液中NO3-的物质的量浓度为25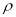 /41mol·L-1
/41mol·L-1
B.要配置浓度为0.25mol·L-1的NaOH溶液480mL,应称量4.8gNaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容
C.配置一定物质的量浓度的溶液定容时,俯视刻度线导致所配浓度偏高
D.配置NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源:2015届四川省资阳市高三一诊理综化学试卷(解析版) 题型:选择题
分类思想是学习化学的重要思想,从分类的角度分析正确的是
A.SO2和NO2溶于水都显酸性,因而它们都是酸性氧化物
B.Na2O和NH3的水溶液均能导电,故均为电解质
C.Si和SiO2均属于原子晶体
D.Na2O和Na2O2与水反应均会生成强碱,故都是碱性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com