
 D、
D、 和
和 E、CH3CH2CH2CH3和
E、CH3CH2CH2CH3和
分析 根据结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;分子式相同,结构不同的化合物互称为同分异构体;质子数相同中子数不同的原子互称同位素;同种元素形成的不同单质互为同素异形体;同种物质指组成和结构都相同的物质;然后对照概念分析.
解答 解:A、O2和O3是氧元素组成的结构不同的单质,互为同素异形体;
B、${\;}_{6}^{12}$C和${\;}_{6}^{13}$C中子数不同,是碳元素的不同原子,互为同位素;
C、CH3CH2CH3 和 结构相似,都属于烷烃,分子组成相差2个CH2原子团,互为同系物;
结构相似,都属于烷烃,分子组成相差2个CH2原子团,互为同系物;
D、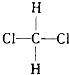 和
和 组成和结构都相同,为同一物质;
组成和结构都相同,为同一物质;
E、CH3CH2CH2CH3和 分子式相同,结构不同,为同分异构体;
分子式相同,结构不同,为同分异构体;
故答案为:A;B;D;C;E.
点评 本题主要考查了同系物、同分异构体、同位素、同素异形体、同一物质的区别,难度不大,注意把握概念的内涵与外延.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
| X | ||||
| R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. ,反应类型取代反应.
,反应类型取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
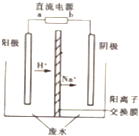 用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.
用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示的分子式为C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.
表示的分子式为C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com