
 H2(g) +CO(g)。 在一定温度下,向体积为2L的密闭容器中加入1 mol C和1 mol H2O,发生上述反应。
H2(g) +CO(g)。 在一定温度下,向体积为2L的密闭容器中加入1 mol C和1 mol H2O,发生上述反应。  2NH3(g) △H= -92.2 kJ.mol-1。反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示,其中t2、t7时刻改变的实验条件分别是:t2_____;t7____
2NH3(g) △H= -92.2 kJ.mol-1。反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示,其中t2、t7时刻改变的实验条件分别是:t2_____;t7____ 
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
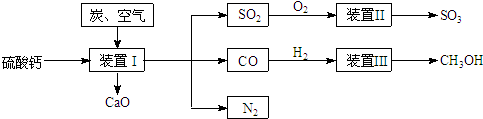
查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:填空题

查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:
金属铝广泛应用于现代生产和日常生活中。
已知:4Al(s)+3O2(g)=2Al2O3(s) △H=-3351.4 kJ?mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1633.2 kJ?mol-1
![]() △H=-5518 kJ?mol-1
△H=-5518 kJ?mol-1
将铝用作燃料已成为现实。回答下列问题:
(1)写出工业制铝的阳极电极反应式 。
(2)①铝用作燃料相对于含碳燃料有明显优点,请你写出其中一条 ;
②铝用作燃料相对于氢气也有明显优点,但也有不足,即燃点高。若要在常温常压不使用催化剂的情况下点燃铝,除了应防止表面生成致密的氧化膜外,还应采取的措施是 。
(3)铝热反应在生产中的应用非常广泛。请写出Fe2O3(s)和Al(s)反应的热化学方程式 ;
铝热实验中能看到有熔融物生成,为探究该熔融物的成分,某学生查阅资料如下:
| 物质 | A1 | A12O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | ― |
经分析,该同学推测,铝热反应所得到的熔融物应是铁铝合金。请设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝(简述实验操作、现象及结论) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com