
下列叙述正确的是
A.将pH=2的盐酸和pH=2的醋酸等体积混合,混合后溶液的pH=2
B.HA—比HB—更难电离,则NaHA溶液的pH一定比NaHB溶液的大
C.在饱和氨水中加入同浓度的氨水,平衡正向移动
D.某温度下,Ba(OH)2溶液中,Kw=10—12,pH=8的该溶液中加入等体积pH=4的盐酸,混合溶液的pH=7
科目:高中化学 来源: 题型:
下列各组物质中,物质之间通过一步反应就能实现图示变化的是
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① |
| NO[] | NO2 | N2 | HNO3 |
| ② | Na2O | Na2O2 | Na | NaOH | |
| ③ | FeCl2 | FeC13 | Fe | CuCl2 | |
| ④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A.①②③ B.①③④ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑
判断能否设计成原电池A. ,B. 。(填“能”或“不能”)
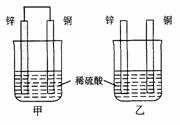 (2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:
甲________乙(填“>”、“<“或“=” )
③请写出图中构成原电池的负极电极反应式_________________________。
④当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入 极(填a或b,下同),电子从 极流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象的描述正确的是
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾
B.向碳酸钠、碳酸氢钠的饱和溶液中滴加酚酞,仅前者溶液变红
C.铜在氯气中燃烧,产生棕黄色烟
D.在硫酸亚铁溶液中滴加稀K3[Fe(CN)6]后,变为特征性蓝色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有FeBr2、FeI2的溶液中通入一定量的氯气后,再向溶液中滴加KSCN
溶液,溶液变为红色,则下列叙述不正确的是
A.通入氯气后的溶液中一定不存在I-;
B.通入氯气之后原溶液中的Fe2+全部被氧化;
C.原溶液中的Br-可能被氧化;
D.若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,下层
溶液可能呈紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,向一体积为2 L的恒容密闭容器中充入2 mol A、1mol B,发生如下反应:2A(g)+B 3C(g) △H=—Q kJ/mol(Q>0)。经过60 s达到平衡,测得B物质的量为0.2 mol,下列对该平衡的叙述正确的是
3C(g) △H=—Q kJ/mol(Q>0)。经过60 s达到平衡,测得B物质的量为0.2 mol,下列对该平衡的叙述正确的是
A.用A浓度表示该反应速率为1.6 mol/(L•min)
B.若使容器变为1 L,则B的物质的量一定减小
C.达到平衡,测得放出热量为x kJ,则x=Q
D.若向容器再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组模拟工业无隔膜电解法处理电镀含氰废水,进行以下有关实验。填写下列空白:
 实验I:制取次氯酸钠溶液
实验I:制取次氯酸钠溶液
用石墨作电极电解饱和食盐水制取次氯酸钠溶液,设计
右图所示装置进行实验。
(1)电源中,a电极名称是__________。
(2)反应时,生成次氯酸钠的离子方程式为
__________________________________________。
实验II:测定含氰废水处理百分率
利用下图所示装置进行实验。将CN—的浓度为0.2 mol/L的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
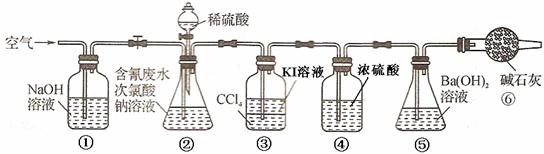
已知装置②中发生的主要反应依次为:
CN— + ClO— = CNO— + Cl—,
2CNO— + 2H+ + 3ClO— = N2↑ + 2CO2↑ + 3Cl— + H2O。
(3)①和⑥的作用是_______________________________________________。
(4)装置②中,生成需由装置③除去的物质的离子方程式为:
______________________________________________________.
(5)反应结束后,缓缓通入空气的目的是_____________________________
_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是 ( )。
A.常温常压下,17 g甲基(—14CH3)所含的中子数为9 NA
B.标准状 况下,11.2 L苯中含有的碳碳双键数为1.5 NA
况下,11.2 L苯中含有的碳碳双键数为1.5 NA
C.42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3 NA
D.1 mol氯气与氢氧化钙溶液完全反应生成氯化钙和氯酸钙,转移的电子数
为6 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com