
【题目】金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是__________
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2H2O,该反应的还原剂是______,当1mol O2发生反应时,还原剂所失电子的物质的量为____mol。向CuSO4溶液中加入镁条时有气体生成,该气体是______。
(3)右图为电解精炼银的示意图,________(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为____________。

(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为_________。
【答案】 bd Cu2S 4 氢气 a NO3-+3e-+4H+=NO↑+2H2O 做电解质溶液,形成原电池。
【解析】试题分析:(1)电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得;
(2)失电子化合价升高的反应物是还原剂,根据得失电子相等计算失去电子的物质的量,硫酸铜溶液呈酸性,镁和酸反应生成氢气;
(3)电解精炼银时,粗银作阳极,若b极有少量红棕色气体生成,则b电极上硝酸根离子得电子生成二氧化氮;
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,该装置构成原电池,食盐水作电解质溶液,促进溶液的导电性.
解:(1)活泼金属采用电解法冶炼,钠、铝都是活泼金属,采用电解熔融态NaCl、Al2O3的方法冶炼,故选bd;
(2)在该反应中,Cu元素化合价由+1升高到+2,S元素由﹣2升高到+6,所以Cu2S做还原剂;
氧化还原反应中得失电子数相等,所以当有1molO2参与反应时失去4mol电子,则还原剂所失电子的物质的量为4mol;
硫酸铜是强酸弱碱盐,其溶液呈酸性,镁和酸反应生成氢气,
故答案为:Cu2S;4;氢气;
(3)电解精炼时,粗银做阳极,所以粗银是a极;
b电极是阴极,发生还原反应,生成了红棕色气体是NO2,电极反应:NO3﹣+e﹣+2H+=NO2↑+H2O,
故答案为:a;NO3﹣+e﹣+2H+=NO2↑+H2O;
(4)该装置构成原电池,氯化钠溶液作电解质溶液,促进溶液的导电能力,故答案为:作电解质溶液,形成原电池.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】离子反应方程式正确的是( )
A. NH4HCO3溶液中加入过量NaOH溶液并加热: NH4++ OH-==NH3↑+H2O
B. 足量的NaOH溶液中逐渐滴入Ca(HCO3)2溶液: Ca2++HCO3- +OH-==H2O+CaCO3↓
C. 明矾溶液中滴加Ba(OH)2溶液到生成的沉淀质量最大时:2Al3++3SO42-+3Ba2++6OH-==3BaSO4↓+2Al(OH)3↓
D. FeBr2溶液中通入足量氯气:2Fe2++4Br﹣+3Cl2=2Fe3++2Br2+6Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要2mol﹒L-1的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl质量分别是
A. 950 mL 111.2 g B. 500 mL 117 g
C. 1 000 mL 111.2 g D. 1 000 mL 117 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①Fe(s)+CO2(g) FeO(s)+CO(g) △H=akJ/mol,
②Fe(s)+H2O(g) FeO(s)+H2(g) △H=bkJ/mol,
以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
下列有关叙述正确的是( )
A. b>0 B. a<0 C. a>b D. 在973K下增大压强,K2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均可行的是( )
编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
A | 己烷(己烯) | 溴水 | 分液 |
B | 淀粉溶液(NaCl) | 水 | 过滤 |
C | 甲苯(乙酸) | NaOH溶液 | 分液 |
D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在常温下均为非自发反应,则在高温下仍为非自发的是
A.2CO(g)=2 C(s)+ O2(g)
B.2CuO(s)=Cu2O(s)+1/2O2(g)
C.MgCO3(s)=MgO(s)+CO2 (g)
D.SnO2(s)+C(s)=Sn(s)+CO2 (g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
铜![]() 铜绿
铜绿![]() A
A![]() Cu(OH)2
Cu(OH)2![]() B
B![]() Cu
Cu
(1)从三种不同分类标准回答,“铜绿”属于哪类物质:________________。
(2)请写出“铜绿”与盐酸反应的化学方程式:______________。
(3)写出④、⑤的化学方程式:
④____________________;⑤______________________。
(4)上述转化过程中属于化合反应的是________,属于复分解反应的是______,属于分解反应的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是( )
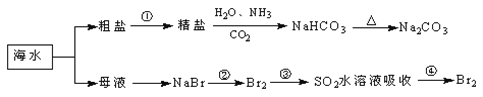
A. 除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤后加盐酸
B. 用澄清的石灰水不可鉴别NaHCO3和Na2CO3
C. 在第②、④步骤中,溴元素均被氧化
D. 从第②步到第④步的目的是为了富集
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com