
【题目】我国科学家在1965年9月首先用人工方法合成牛胰岛素。为了证实人工合成的胰岛素与天然的是否是同一物质,在人工合成牛胰岛素过程中掺入了放射性14C,然后将人工合成的牛胰岛素与天然的混合得到了放射性14C分布均匀的结晶物,从而证明了两者都是同一种物质,为我国在国际上首先合成具有生物活性牛胰岛素提供了有力证据。在人工合成过程中掺入放射性14C的用途是 ( )
A. 催化剂 B. 媒介质 C. 组成元素 D. 示踪原子
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】从一种含银矿(含Ag、Zn、Cu、Pb及少量SiO2)中提取Ag、Cu及Pb的工艺流程如下:

(1)步骤①提高矿物中金属离子浸取率,除可改变盐酸的浓度和氯酸钾的量外,还可采取的措施是__________(写出两种即可)
(2)步骤②中试剂X为______ (填化学式,下同);步骤④滤渣的成分为_______。
(3)步骤③发生反应的化学方程式为____________________。
(4)步骤⑤发生反应的离子方程式为____________________;其中N2H4(肼) 的电子式为____。
(5)“还原”后的“滤液”经氧化后,其中的溶质主要为_______。
(6) 已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。若在AgC1的悬浊液中加入NaCl 固体,AgCl 沉淀的溶解度_____ (填“升高”、“不变”或“降低”),往AgCl 的悬浊液中滴加NaI溶液,当AgCl 开始转化为AgI时,I-的浓度必须不低于_____mol/L (不用化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:

(1)Na2MoO4·2H2O中钼元素的化合价为______;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是_______(答出一条即可);
(3)试配平焙烧过程中钼精矿发生的主要反应的化学方程式
为__MoS2+__O2![]() __MoO3+___SO2,该反应中氧化产物是________(填化学式)
__MoO3+___SO2,该反应中氧化产物是________(填化学式)
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___________;
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:

①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是____。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是__。
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO |
|
|
电离平衡常数 |
|
|
|
|
(1)室温下![]()
![]()
![]()
![]()
![]() 溶液的pH由大到小的关系为______.
溶液的pH由大到小的关系为______.
(2)浓度均为![]() 的
的![]() 和
和![]() 的混合溶液中,
的混合溶液中, ![]() 、
、![]() 、
、![]() 、
、![]() 浓度从大到小的顺序为______.
浓度从大到小的顺序为______.
(3)少量![]() 通入到过量的NaClO溶液中发生反应的离子方程式______.
通入到过量的NaClO溶液中发生反应的离子方程式______.
(4)常温下, ![]() 的HCOOH溶液与
的HCOOH溶液与![]() 的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为______.
的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及硅的化合物的叙述中,正确的是( )
A. 硅是光导纤维的主要成分 B. 硅是构成岩石与许多矿物的基本元素
C. SiO2是酸性氧化物,不与任何酸发生反应 D. 可以通过SiO2一步制得硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物A是一种农药生产的中间体,A在一定条件下可发生如图转化:

请回答下列问题:
(1)![]() 分子中不含氧官能团的名称为 ______ .
分子中不含氧官能团的名称为 ______ .
(2)![]() 不能发生反应的类型有 ______
不能发生反应的类型有 ______ ![]() 填字母
填字母![]() .
.
![]() 取代反应
取代反应![]() 消去反应
消去反应![]() 加成反应
加成反应![]() 氧化反应
氧化反应
(3)反应![]() 的化学方程式为 ______ .
的化学方程式为 ______ .
(4)写出B到C的离子方程式 ______ .
(5)![]() 在一定条件下反应能生成高分子化合物,写出此高分子化合物所有可能的结构简式: ______ .
在一定条件下反应能生成高分子化合物,写出此高分子化合物所有可能的结构简式: ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基础知识填空:
(1)氢氧化铁胶体制备的化学方程式_______________,所得分散系及下列物质分别用激光照射,与该分散系现象相同的是______。
A、淀粉溶液 B、澄清水 C、纳米铁 D、豆浆
(2)装置的选择:
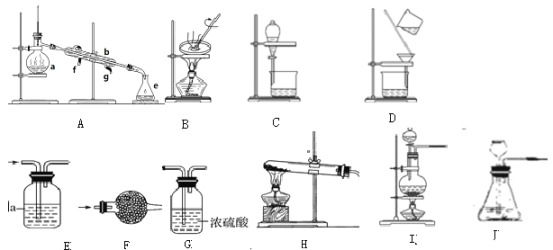
a、干燥氨气______。
b、分离植物油和水______。
c、检验CO中的是否含有CO2______。
d、分离碘和四氯化碳______。
e、实验室用氢氧化钙和氯化铵共热制氨气______。
f、实验室用稀盐酸和石制二氧化碳______。
(3)以物质的量为中心的计算
①、12.4gNa2X中含Na+0.4mol,则X的相对原子质量是______。
②、500mL质量分数为49%的硫酸溶液,密度为1.392g/cm3,则溶液的物质的量浓度为______________mol/L,其中含有SO42-的数目约为______(保留三位有效数字)。
(4)一定物质的量浓度溶液的配制:
①、实验室要配制480mL0.25mol·L-1的FeSO4溶液,需称量绿矾(FeSO4·7H2O)______g,
②、由于错误操作,使得实际浓度比所要求的偏小的是______(填写编号)。
A 称量绿矾时,左码右物
B 使用容量瓶配制溶液时,俯视液面定容,所得溶液的浓度
C 没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D 容量瓶刚用蒸馏水洗净,没有干燥
E 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F 把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
③、定容时,若加蒸馏水时不慎超过刻度线,处理方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaSO4·2H2O受热会逐步失去结晶水。取纯净的CaSO4·2H2O固体3.44 g进行加热,测定固体质量随温度的变化情况如右图所示。C点固体的化学式是________________。T3~T4温度段加热固体所产生的气体是形成酸雨的主要物质之一,则D~E段发生反应的化学方程式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅及其化合物的说法中,正确的是( )
A.硅是常用的半导体材料,可用于制造光导纤维B.二氧化硅是酸性氧化物,故不与任何酸反应
C.硅酸是一种二元弱酸,其酸性强于碳酸D.制造普通玻璃的主要原料是纯碱、石灰石和石英
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com