

分析 根据流程图可知SiCl4水解生成的盐酸和原硅酸,过滤得到盐酸,盐酸与钡矿粉反应,主要生成BaCl2,同时溶液中含有钙、铁、镁等离子,通过调节PH值一一除去,最终得到BaCl2•2H2O.
(1)氯化硅水解生成原硅酸和氯化氢;温度越高,氯化硅的水解速率越大,氯化氢的挥发越强;将两个方程式相加即得则由SiCl4制备硅的热化学方程式,注意焓变进行相应的改变;
(2)加钡矿粉时生成BaCl2是碳酸钡溶解于酸中反应生成;
(3)根据氢氧化铁和氢氧化镁完全沉淀所需溶液的PH值确定滤渣的成分;根据氢氧化钙溶解度随温度升高减小;
(4)根据从溶液中析出固体的方法分析解答.
解答 解:(1)氯化硅水解生成原硅酸和氯化氢,水解方程式为SiCl4+4H2O=H4SiO4↓+4HCl,温度高时,氯化硅的水解速率增大,氯化氢的挥发增强,且氯化氢能污染环境,温度较低时,能防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈,
由盖斯定律可知:将方程式SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol和SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol相加得SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol,
故答案为:防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈;SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol;
(2)碳酸钡和盐酸反应生成氯化钡,反应的方程式为:BaCO3+2H+=Ba2++CO2+H2O↑;
故答案为:BaCO3+2H+=Ba2++CO2+H2O↑;
(3)当pH=3.4时,铁离子完全生成沉淀,所以当pH=7时,滤渣A的成分是氢氧化铁;当pH=12.4时,镁离子完全沉淀生成Mg(OH)2,所以当pH=12.5时,滤渣B的成分是氢氧化镁;控制温度70℃的目的是确保钙离子完全除去;
故答案为:Fe(OH)3;Mg(OH)2;确保钙离子完全除去(或温度越高,Ca(OH)2溶解度越小);
(4)从溶液中制取固体的方法是:蒸发浓缩→冷却结晶→过滤→洗涤;
故答案为:蒸发浓缩、冷却结晶.
点评 本题考查了物质制备流程分析判断,物质性质的应用,盐类水解、沉淀形成条件,杂质除去方法,试剂选择,离子方程式书写,盖斯定律应用,题目难度中等.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 化学反应 | 离子方程式 | 评 价 |
| A | 碳酸钙与 醋酸反应 | CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- | 错误,碳酸钙是弱电解 质,不应写成离子形式 |
| B | 苯酚钠溶液中 通入CO2 | 2C6H5O-+CO2+H2O→2C6H5OH+CO32- | 正确 |
| C | NaHCO3的水解 | HCO3-+H2O=CO32-+H3O+ | 错误,水解方程式 误写成电离方程式 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 错误,离子方程式中 Fe2+与Br-的物质的量 之比与化学式不符 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
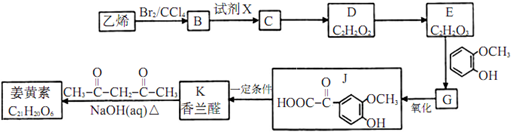

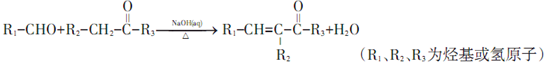
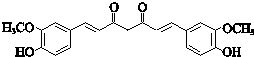 ;
;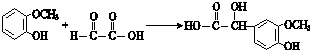 ;其反应类型是加成反应;
;其反应类型是加成反应;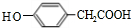 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
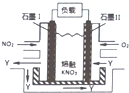 NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )
NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )| A. | NO2在石墨I附近发生氧化反应 | |
| B. | 该电池放电时N03-向石墨I电极迁移 | |
| C. | 石墨Ⅱ附近发生的反应:O2+4e-+2N205=4 N03- | |
| D. | 相同条件下,放电过程中消耗的NO2和O2的体积比为l:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH218O含有l0NA个质子 | |
| B. | 过量铁粉在氯气中燃烧生成FeCl2 | |
| C. | 0.1mol•L-1NaAlO2溶液中可以大量存在:HCO3-、NH4+、SO42-、Fe3+ | |
| D. | 在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明ksp(CuS)远小于Ksp(FeS) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )| A. | 0.5•(a+b-c-d)kJ/mol | B. | 0.5•(c+a-d-b)kJ/mol | ||
| C. | 0.5•(c+d-a-b)kJ/mol | D. | 0.5•(c+d-a-b)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(稀)$→_{△}^{Cu}$SO2$\stackrel{少量氨水}{→}$NH4HSO3$\stackrel{足量氨水}{→}$(NH4)2SO3 | |
| B. | NH3$→_{催化剂△}^{O_{2}}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 | |
| D. | Al$\stackrel{NaOH溶液}{→}$NaAlO2$\stackrel{足量盐酸}{→}$AlCl3溶液$\stackrel{△}{→}$无水AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com