
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-. 现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2 溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- : ,原因是 .
(2)由第二份进行的实验可知混合物中应含有 离子,其物质的量浓度为 .
(3)由第三份进行的实验可知12.54g 沉淀的成份为 。请计算形成该沉淀的原混合物中各离子的物质的量。(要求计算过程)
(4)综合上述实验,你认为以下结论正确的是
| A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol |
| B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl- |
| C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl- |
| D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl- |
(1)否 ; Ag2CO3 Ag2SO4都是沉淀 (答对其中1个算对)
(2)NH4+ 0.8 mol/L
(3)BaCO3 BaSO4 ; n (CO32-)="0.04" mol n(SO42-)="0.02" mol
(4)A (3分)
解析试题分析:根据第二份信息确定溶液中含有NH4+,且量为0.08mol;根据第三份信息得出沉淀为硫酸钡和碳酸钡,量分别为4.66÷233=0.02mol,(12.54-4.66)÷197=0.04mol,故溶液中含有CO32-、SO42-且量分别为0.04mol和0.02mol;(1)硫酸银和碳酸银等均为沉淀,故不能只根据加入AgNO3溶液有沉淀产生得出含有Cl- 结论;(4)根据溶液中含有CO32-、SO42-判断溶液中不含有Ca2+、Ba2+;根据电荷守恒,得出溶液中一定含有阳离子即含有K+(溶液中CO32-、SO42-所带负电荷数大于NH4+所带正电荷数),可能含有Cl- ,若不含时n(K+)=2n(CO32-)+2n(SO42-)-n(NH4+)[电荷守恒]=0.04mol,若含有Cl- ,则n(K+)>0.04mol,故答案为A。
考点:考查定性和定量检验溶液中的离子有关问题。


科目:高中化学 来源: 题型:填空题
Ⅰ.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为 。
其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命。以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 。
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为:2Al+3Ag2O+2NaOH+3H2O 2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
,正极附近溶液的pH (填“变大”、“不变”或“变小”)。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。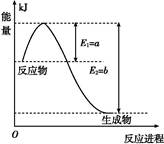
(1)如图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
| A.增大压强 | B.增大反应物的浓度 |
| C.使用催化剂 | D.降低温度 |
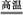 6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为0.1mol。若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
(1)若向该溶液中加入过量的稀硫酸和KSCN溶液,现象是: ;
(2)写出向该溶液中加入过量的稀硫酸发生反应的离子方程式为:________________________________________________________________________;
(3)经分析,该溶液仅含的4种离子是:______________________________________;
(4)判定另外3种离子不能存在的主要依据有三个:
①向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变,②所含离子的物质的量均为0.1mol,则③是__________________________________________;
(5) 若向该溶液中加入足量的NaOH溶液,将所得的沉淀过滤再灼烧,最后所得固体的质量为______g
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种可溶性盐,分别由Na+、Ba2+、Cu2+、Ag+、CO32—、SO42—、Cl—、NO3—中的不同阳离子和阴离子各一种组成。现做以下实验:
① 将四种盐各取少量,分别溶于盛有5 mL蒸馏水的四支试管中,只有B盐溶液呈蓝色。
② 分别向4支试管中加入2 mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
根据上述事实,推断这四种盐的化学式分别为:
A B C D
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一瓶无色澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、H+、Cu2+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显紫红色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有___________,肯定不存在的离子有__________________。
(2)写出实验④中的离子反应方程式 ,
(3)不能确定是否存在的离子有__________________________。请设计简单实验方案证明它(们)是否存在(写出实验方法、现象、结论)__________ _________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S 、HNO3、NO 、H2O;则该反应中还原产物是_____;若反应过程中转移了0.3mol电子,则氧化产物的质量是_____g。
(2)将a mol Cl2通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-,写出另2个可能发生的离子方程式。
①当 a / b =1时 ;
②当a / b≥3/2时 。
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O  Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
(Ⅰ)已知B(OH)3是一元弱酸,试写出其电离方程式: ;
(Ⅱ)单质氰(CN)2是类卤素,试写出其与氢氧化钠溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)实验室中常用加热分解氯酸钾制取氧气,写出反应的化学方程式,并用双线桥法标出电子转移情况: 。
(2)生活中常用食醋除去水壶中的水垢(主要成分是碳酸钙固体)的离子方程为: 。
(3)钢铁在潮湿环境中溶液锈蚀,反应的氧化剂是 。工业上常用稀硫酸进行焊接前除锈(主要成分是Fe2O3?xH2O),反应的离子方程为: 。
(4)医疗上常用小苏打治疗胃酸过多,小苏打溶液与盐酸反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;将沉淀过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。
回答下列问题:
(1)原溶液中一定不存在 。
(2)根据实验和必要的计算确定溶液中一定存在的离子有哪些 (写出必要的推理及计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在学习了铜元素的性质之后,小明同学做了H2O2与铜的有关探究实验:
实验一:将铜丝置于装有H2O2溶液的试管中,没有气体产生;加热溶液时,观察到铜丝表面产生大量气体。
实验二:将铜丝置于装有硫酸酸化的H2O2溶液的试管中,溶液迅速变蓝。同时产生大量气体。
请回答下列问题:
(1)上述实验一(加热时)、实验二中铜丝表面均产生了大量气体,该气体是 。
(2)写出在酸性条件下H2O2氧化铜丝的离子方程式: 。
(3)H2O2能发生多种化学反应,等物质的量的H2O2在仅作氧化剂的反应、仅作还原剂的反应和分解反应中转移的电子数目之比为 。
小明同学设计了以废铜屑制取硫酸铜的三个方案: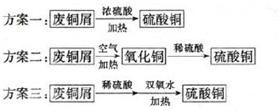
①认为最佳方案是 。
②简述另两个方案的不足之处: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com