
| A. | NaClO 溶液中通入过量SO2 ClO -+SO2+H2O═HClO+HSO3- | |
| B. | 甲醇、氧气和氢氧化钾溶液组成的燃料电池的负极反应CH3OH+H2O-6e-═CO2↑+6H+ | |
| C. | AlCl3 溶液中投入过量Na:Al3++4Na+2H2O═AlO2 -+4Na++2H2↑ | |
| D. | 向明矾溶液中滴加Ba(OH)2,恰好使SO42- 沉淀完全:2Al3++3SO4 2-+3Ba2++6OH -═2Al(OH)3↓+3BaSO4↓ |
分析 A.次氯酸根离子能够氧化二氧化硫生成硫酸根离子;
B.碱性甲醇燃料电池中,甲醇被氧化,应为原电池负极反应;
C.钠与水反应生成氢气和氢氧化钠,氢氧化钠与氯化铝反应生成偏铝酸钠和水;
D.硫酸根离子恰好沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,二者反应生成偏铝酸根离子.
解答 解:A.NaClO溶液中通入过量SO2气体的离子反应为ClO-+H2O+SO2═2H++Cl-+SO42-,评价不合理,故A错误;
B.负极上甲醇失电子被氧化,生成碳酸根离子,电极反应式为:CH3OH-6e-+8OH-═CO32-+6H2O,故B错误;
C.AlCl3 溶液中投入过量Na,离子方程式:Al3++4Na+2H2O═AlO2 -+4Na++2H2↑,故C正确;
D.明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,硫酸铝钾与氢氧化钡的物质的量之比为1:2,反应生成偏铝酸钠,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:电荷守恒、原子个数守恒,反应是否符合客观事实,反应物用量对反应的影响.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(OH-)减小 | B. | pH的变化值等于2 | ||
| C. | 溶液中H+的个数增大 | D. | Kw的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视液面 | B. | 未洗涤烧杯和玻璃棒 | ||
| C. | 容量瓶未干燥 | D. | 转移溶液前溶液未冷却至室温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol H2O2分子中的非极性共价键数为NA | |
| B. | 1L 0.lmol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 钢铁发生析氢腐蚀时,0.56gFe反应转移电子数为0.03NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 360 kJ/mol | B. | 263 kJ/mol | C. | 1 173 kJ/mol | D. | 391 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
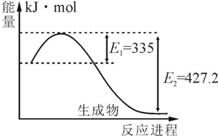 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
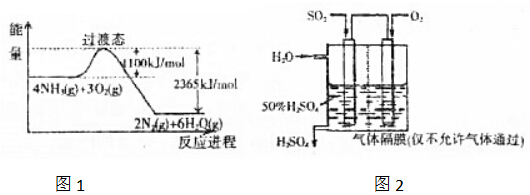
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些 昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)
昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO物质
COS(g)+H2(g) K=0.1反应前CO物质 的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是
的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.CO的平衡转化率为80%
D.反应前H2S物质的量为7 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com