
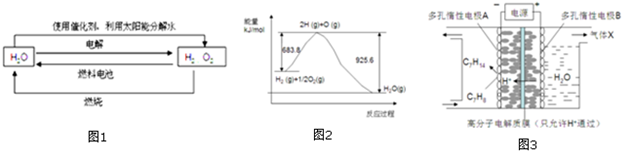
分析 (1)根据如图1中4个过程中能量转化形式分析;
(2)根据焓变只与反应物和生成物的状态及其系数有关来分析;
(3)由图象可知H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=683.8-925.6=-241.8kJ•mol-1,结合H2O(l)=H2O(g)△H=+44kJ•mol-1利用盖斯定律进行计算;
(4)①NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,H元素化合价由-1价、+1价变为0价,结合转移电子守恒配平方程式;
②根据LaNi5(s)+3H2(g)?LaNi5H6(s)△H<0,欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,据此分析;
③该实验的目的是储氢,根据反应总反应,得出电解过程中产生的气体X为O2;电极A上发生的反应C7H8得电子和氢离子生成C7H14.
解答 解:(1)由如图1中4个过程,则能量转化形式有太阳能转化成电能,电能与化学能之间的转化,化学能转化成热能,光能等,所以4个过程中能量转化形式有4种以上,故选:D;
(2)因为焓变只与反应物和生成物的状态及其系数有关,所以2H2O(1)$\frac{\underline{\;通电\;}}{\;}$2H2(g)+O2(g)△H1 2H2O(1)$\frac{\underline{\;\;\;光照\;\;\;}}{催化剂}$2H2(g)+O2(g)△H2,反应物生成物完全相同,所以△H1=△H2;
故答案为:=;
(3)由图象可知①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=683.8-925.6=-241.8kJ•mol-1,
已知②H2O(l)=H2O(g)△H=+44kJ•mol-1,
利用盖斯定律将①×2-②×2可知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,
故答案为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1;
(4)①NaBH4与水发生氧化还原反应生成NaBO2和H2,化学方程式为:NaBH4+2H2O=NaBO2+4H2↑;
故答案为:NaBH4+2H2O=NaBO2+4H2↑;
②欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,由LaNi5(s)+3H2(g)?LaNi5H6(s)△H<0为气体减小的放热反应,所以可以升高温度或降低压强,平衡向逆向移动;故答案为:升高温度或降低压强;
③该实验的目的是储氢,根据反应总反应,得出电解过程中产生的气体X为O2;电极A上发生的反应C7H8得电子和氢离子生成C7H14,反应式为 C7H8+6H++6e-═C7H14;故答案为:O2;C7H8+6H++6e-═C7H14.
点评 本题考查了盖斯定律的应用、化学平衡及其电解池原理等知识点,根据化学平衡移动原理、电解原理等知识点来分析解答,难度中等,侧重于考查学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 | |
| C. | 如图是某有机物分子的比例模型,该物质可能是一种氨基酸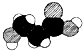 | |
| D. | 化合物 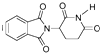 在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开1molH-H键需要的能量小于断开1molCl-Cl键需要的能量 | |
| B. | 反应在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能小于反应②的活化能 | |
| D. | 已知反应②的△H>0,则反应③的△H一定小于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双氰胺结构简式如图.
双氰胺结构简式如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Fe2+、Cl- | B. | K+、Fe3+、NO3-、Fe(OH)3(胶体) | ||
| C. | Cl-、SCN-、NH4+、葡萄糖分子 | D. | OH-、Na+、苯酚、Br - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中MnO2和H2SO4都是氧化剂 | |
| B. | 反应①中每析出12.8g S沉淀,转移0.8mol电子 | |
| C. | 金属锌也可用热还原法制备 | |
| D. | 硫酸在生产种可循环使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂化的主要目的是为了提高轻质液体燃料的产量 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 冶炼铬可采用铝热法 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释与说明 |
| A | 苹果放在空气中久置变黄和纸张久置变黄 | 二者变黄的原理相似 |
| B | 用四氯化碳进行衣服的干洗 | 目的是节约用水 |
| C | 钢铁制品和铜制品在空气中被腐蚀 | 二者既能发生吸氧腐蚀又能发生析氢腐蚀 |
| D | 形成黄河入海口沙洲、用卤水点豆腐 | 都体现了胶体聚沉的性质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com