
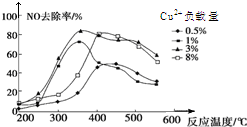
 ��������Ӱ�����ǵ��������β�����ŷ������������������Ҫԭ��֮һ����֪����β���ŷ�ʱ���������·�Ӧ��
��������Ӱ�����ǵ��������β�����ŷ������������������Ҫԭ��֮һ����֪����β���ŷ�ʱ���������·�Ӧ������ ��1�����ݸ�˹���ɣ���Ӧ�ڡ�2-�ټ��ã�ȷ����Ӧ��2CO��g��+2NO��g��?N2��g��+2CO2��g�����ݴ˼����ʱ䣻
��2�����ݷ�Ӧ�ٵķ���ʽ�ó�Kp=$\frac{{P}^{2}��NO��}{P��{N}_{2}��P��{O}_{2}��}$��
��3����ѧ��Ӧ�ﵽ��ѧƽ��״̬ʱ�����淴Ӧ������ȣ��Ҳ�����0�������ʵ�Ũ�Ȳ��ٷ����仯���ɴ�������һЩ�������������仯���Դ˽����жϣ��ó���ȷ���ۣ�
��4����������ʽ�����ת���ʵ���$\frac{�仯��}{��ʼ��}��100%$��
��5�������ʸߣ������ʵͣ����˵��¶ȣ�
��� �⣺��1�����ݸ�˹���ɣ���Ӧ�ڡ�2-�ټ��ã�ȷ����Ӧ��2CO��g��+2NO��g��?N2��g��+2CO2��g����H4=��2b-a��KJ/mol���ʴ�Ϊ��2b-a������14�֣���ÿ��2�֣���2�����ݷ�Ӧ�ٵķ���ʽ�ó�Kp=$\frac{{P}^{2}��NO��}{P��{N}_{2}��P��{O}_{2}��}$���ʴ�Ϊ��$\frac{{P}^{2}��NO��}{P��{N}_{2}��P��{O}_{2}��}$��
��3��A����λʱ��������1mol CO2��ͬʱ������lmol CO������������Ӧ����δ����������Ĺ�ϵ���ʴ���
B���ں��º��ݵ������У����������ܶ�һֱ���ֲ��䣬�ʴ���
C���ھ��Ⱥ��ݵ������У���Ӧ��ƽ�ⳣ�����ٱ仯��˵����ϵ�¶Ȳ��䣬���淴Ӧ������ȣ�����ȷ��
D���ں��º�ѹ�������У�NO������������ֲ��䣬˵�������ʵ������䣬��Ӧ��ƽ��״̬������ȷ��
��ѡCD��
��4��2CO��g��+2NO��g��?N2��g��+2CO2��g��
��ʼ������x+2y��mol ��2x+2y��mol 0 0
�仯����2ymol 2ymol ymol 2ymol
ƽ������xmol 2xmol ymol 2ymol
����NO��ƽ��ת����Ϊ$\frac{2y}{2x+2y}��100%$=$\frac{x}{x+y}��100%$��Q=$\frac{��3y��^{2}��y}{{x}^{2}����3x��^{2}}$=$\frac{{y}^{3}}{{x}^{4}}$=K������ƽ�ⲻ�ƶ���v������=v���棩���ʴ�Ϊ��$\frac{x}{x+y}��100%$��=��
��5�����������ʸߣ������ʵͣ����˵��¶ȣ���ͼ��֪���ʺ�����Ϊ350�桢������3%���ʴ�Ϊ��350�桢������3%��
���� ���⿼���˹���ɵ�Ӧ�á���ѧƽ��״̬���жϡ�����ʽ��ƽ�ⳣ�������ã��Ѷ��еȣ�����ͼ��������ֽ��ʵı仯�ص��ǽ���Ĺؼ������ջ����ǹؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳ���ۻ� | B�� | ������ۻ� | C�� | ������ | D�� | ���������ۻ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������ˮ�� | B�� | ����������ˮ����ɫ | ||
| C�� | Һ��ʯ��������Ҫ�ɷ�ΪCH4 | D�� | ú��Һ�����������仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
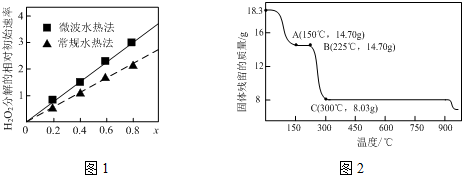
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
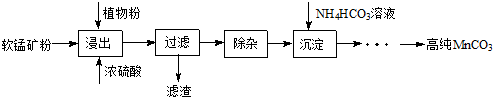
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ�е����̪��Һ����Һ��죺NH3•H2O=NH4++OH- | |
| B�� | 90��ʱ����ô�ˮ��c��H+��•c��OH-��=3.8��10-13��H2O��l��?H+��aq��+OH-��aq����H��0 | |
| C�� | ������Һ��ͨ��CO2����Һ����ǣ�2C6H5ONa+CO2+H2O��2C6H5OH+Na2CO3 | |
| D�� | FeCl3��Һ��ͨ��SO2����Һ��ɫ��ȥ��2Fe3++SO2 +2H2O=2Fe2++SO42-+4H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ�ӵ�ԭ�ӽṹʾ��ͼ�� | |
| B�� | �ǻ��Ľṹʽ��O-H | |
| C�� | �õ���ʽ��ʾNa2O���γɹ��̣� | |
| D�� | ���ΪC2H6O�ķ����п���ֻ���ڼ��Լ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | y=x%��$\frac{1}{2}$ | B�� | y=1-x%��$\frac{2}{3}$ | C�� | y=x%��$\frac{1}{3}$ | D�� | y=1-2x%��$\frac{1}{3}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
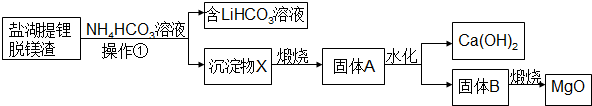
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com