
分析 (1)同种非金属元素之间形成非极性共价键;
(2)形成配位键两个原子,一方提供空轨道、一方提供孤对电子;
(3)既含有σ键又含有π键应为双键或三键;
(4)结构对称,正负电荷重心重叠的分子为非极性分子;
(5)分子的立体结构呈平面三角形的为sp2杂化;
(6)含有离子键的化合物为离子化合物,由离子化合物形成的晶体为离子晶体.
解答 解:(1)乙醇中含有C-C键,为非极性键,故答案为:⑥;
(2)氯化铵中含有配位键,故答案为:③;
(3)二氧化碳和甲醛中分别含有C=C键、C=O键,含有σ键又含有π键,故答案为:①⑤;
(4)二氧化碳为直线形分子,结构对称,为非极性分子,故答案为:①;
(5)甲醛中C为sp2杂化,且无孤电子对,为平面三角形,故答案为:⑤;
(6)氯化铵、氢氧化钾含有离子键,为离子化合物,形成的晶体为离子晶体,故答案为:③④.
点评 本题考查化学键及其分类,为高频考点,侧重于学生的分析能力的考查,明确元素的类别及元素的成键是解答本题的关键,难度较小.


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:解答题
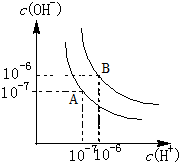 按要求填空:
按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
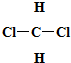 和
和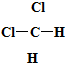 ⑥CH3CH2CH2CH3和
⑥CH3CH2CH2CH3和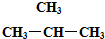
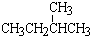 ;
; ③
③ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:F>CI>Br | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数都相同 | D. | 最外层电子数都不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 (R,R′,R″代表相同或不相同的烃基)
(R,R′,R″代表相同或不相同的烃基) .
. .
. .
.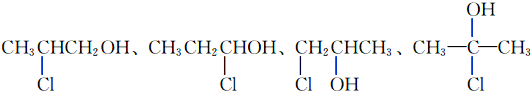 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把煤块变成煤粉燃烧更为剧烈 | |
| B. | 锌与稀硫酸反应制H2时加入少量CuSO4溶液而使反应速率加快 | |
| C. | 固态FeCl3和固态NaOH混合后,加入水能迅速产生沉淀 | |
| D. | 双氧水中加入少量MnO2,即可迅速放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 实验 编号 | 铜片 质量/g | 0.1mol•L-1 硝酸/mL | 硝酸铜 溶液/mL | 亚硝酸钠 溶液/mL | 水的体积 /mL | 实验目的 |
| ① | 5 | 20 | 0 | 0 | 0.5 | 实验①和②探究Cu2+对实验的影响;实验①和③探究亚硝酸根的影响. |
| ② | 5 | 20 | 0.5 | 0 | 0 | |
| ③ | 5 | 20 | 0 | X | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com