
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)先根据溶液中电荷守恒计算氢离子的浓度,然后求出pH;
(2)二氧化硫使酸性氧化物和碱或碱性盐溶液反应;
(3)①计算出平衡时各种物质的物质的量,结合平衡常数的表达式计算;
②依据化学反应速率和平衡移动原理分析判断;
③根据G=△H-T•△S判断反应能否自发进行;
解答 解:(1)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性;试样的pH值根据溶液中电荷守恒:c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-)计算H+离子浓度为10-4,该样本的pH=4,
故答案为:酸性;4;
(2)洗涤含SO2的烟气,根据酸性氧化物的性质可选a.Ca(OH)2 b.Na2CO3,而氯化钙和亚硫酸氢钠不与二氧化硫反应,
故答案为:ab;
(3)①气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
故答案为:吸热反应,温度升高,平衡正向移动,NO的含量增大;
②2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T•△S,G>0,不能实现,
故答案为:)①②△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
点评 该题综合考查化学反应原理的基础知识,涉及离子的水解、pH值的计算、化学平衡常数的计算、自由能的应用等,题目难度中等,注意相关知识的积累.


科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
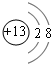 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

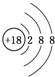 .元素K名称为氯在周期表中的位置第三周期第ⅦA族.
.元素K名称为氯在周期表中的位置第三周期第ⅦA族.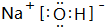
 HClO+HCl.
HClO+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z为0.3 mol•L-1 | B. | Y2为0.1 mol•L-1 | C. | X2为0.2 mol•L-1 | D. | Z为0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
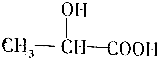 ,
,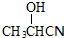 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4甲基4,5二乙基己烷 | B. | 2,3-二甲基-2,4-戊二烯 | ||
| C. | CH3CH(OH)CH2CH3:丁醇 | D. | 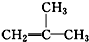 :2-甲基-1-丙烯 :2-甲基-1-丙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com