
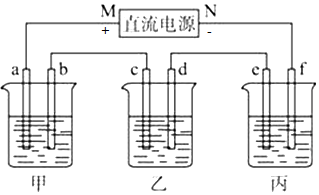
分析 (1)甲是电解饱和食盐水,M为正极,则a为阳极发生氧化反应,b为阴极发生还原反应,电解饱和食盐水生成氢气、氯气和氢氧化钠;
(2)乙是铜的电解精炼,粗铜应作阳极即c极,精铜作阴极即d极,阳极与电池的正极相连发生氧化反应,阴极与电池的负极相连发生还原反应;金属的活动性顺序为Zn>Fe>Cu>Ag>Pt,因此在电解过程中Ag、Au不会失去电子,而是形成阳极泥,根据电解原理来解答;
(3)要在铁制品上镀镍(二价金属),则铁作阴极与电源负极N相连即f极,镍为阳极与电源正极M相连即e极;
(4)根据转移电子数相等计算.
解答 解:(1)甲是电解饱和食盐水,M为正极,则a为阳极发生氧化反应,b为阴极发生还原反应,电极反应式为2H++2e-=H2↑,电解饱和食盐水生成氢气、氯气和氢氧化钠,总反应化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaCl+Cl2↑+H2↑,故答案为:2H++2e-=H2↑;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaCl+Cl2↑+H2↑;
(2)用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极,该装置中M为原电池的正极,N为原电池的负极,所以c为电解池的阳极,d为电解池的阴极,电解时,以硫酸铜溶液为电解液,溶液中的Cu2+得到电子在阴极上发生还原反应,即Cu2++2e-=Cu;作阳极的粗铜中的铜以及比铜活泼的金属失去电子进入溶液,所以Fe发生Fe-2e-═Fe2+反应,以Fe2+的形式进入溶液中;比铜不活泼的金属Au、Ag不会失去电子,以单质的形成沉入电解槽形成“阳极泥”,则沉积在电解槽底部(阳极泥)的杂质是Au、Ag,电解一段时间后,电解液中的金属离子有Cu2+、Fe2+,
故答案为:粗铜板;Cu2++2e-=Cu;Au、Ag;Cu2+、Fe2+;
(3)要在铁制品上镀镍(二价金属),则铁作阴极与电源负极N相连即f极,镍为阳极与电源正极M相连即e极,故答案为:镍块;铁制品;
(4)若e电极的质量变化118g,根据转移电子数相等,Ni~2e-~Cl2,则a电极上产生的气体在标准状况下的体积为$\frac{118g}{59g/mol}$×22.4L/mol=44.8L,故答案为:44.8L.
点评 本题考查电解原理,侧重于学生的分析能力和计算能力的考查,难度中等,注意把握离子的放电顺序,为解答该题的关键.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的氨水中有0.1NA个NH4+ | |
| B. | 标准状况下,22.4L盐酸含有NA个HCI分子 | |
| C. | 常温常压下,14g由N2与CO的混合气体含有0.5NA个原子 | |
| D. | 标准状况下,6.72L N02与水充分反应转移0.2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,氧化产物是K2SO3,氧化剂与还原剂的物质的量之比为2:1,若反应中消耗了0.6molS,则反应中转移的电子为0.8mol.
,氧化产物是K2SO3,氧化剂与还原剂的物质的量之比为2:1,若反应中消耗了0.6molS,则反应中转移的电子为0.8mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
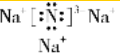 ,该化合物是由离子键形成的.
,该化合物是由离子键形成的.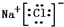 、
、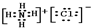 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据物质能否导电将物质分为电解质和非电解质 | |
| B. | 根据反应中的热效应将化学反应分为放热反应和吸热反应 | |
| C. | 根据溶液导电性强弱将电解质分为强电解质和弱非电解质 | |
| D. | 根据元素的化合价的高低将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com