
【题目】浓度均为0.1 mol·L-1、体积为V0的HA酸溶液和MOH碱溶液,分别加蒸馏水稀释,溶液pH随滴入的蒸馏水体积的变化曲线如图所示,下列叙述正确的是( )
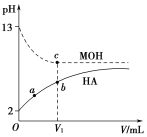
A. HA为强酸,MOH为强碱
B. a点HA的电离度小于10%
C. 两种溶液无限稀释时,其c(H+)近似相等
D. 两种溶液稀释至V1时,b、c两点所示溶液中c(A-)>c(M+)
【答案】C
【解析】
本题考查强弱电解质的稀释问题。解答时根据图像的pH知HA为弱酸,MOH为强碱;又知道稀释时促进弱电解质电离,其电离度也增大。无论强碱还是弱酸无限稀释其c(H+)近似相等的; MOH为强碱,完全电离,而HA为弱酸,部分电离,浓度均为0.1 mol·L-1的HA酸溶液和MOH碱溶液稀释相同倍数时,c(M+)>c(A-)。
A.若HA为强酸,则0.1 mol·L-1的该溶液pH=1,而图中其pH=2, HA为弱酸,故A项错误;B.对于HA溶液,在滴加蒸馏水前,溶液pH=2,即溶液中c(H+)=0.01 mol·L-1,故其电离度为10%,溶液越稀,促进电离,其电离度增大,故a点HA的电离度大于10%,故B项错误;酸碱溶液无限稀释时,溶液中的c(H+)≈c(OH-)≈1×10-7mol·L-1,故C项正确;D.由图像知MOH为强碱,完全电离,而HA为弱酸,部分电离,浓度均为0.1 mol·L-1的HA酸溶液和MOH碱溶液稀释相同倍数时,c(M+)>c(A-),故D项错误。


科目:高中化学 来源: 题型:
【题目】将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )
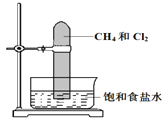
A. 试管中气体的黄绿色逐渐变浅,水面上升
B. 生成物只有三氯甲烷和氯化氢在标准状况下是气体
C. 试管内壁有油状液滴形成
D. 试管内有少量白雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化合物是目前造成大气污染的主要气体,而汽车尾气中就含有NO 等多种污染气体。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:
(1) 已知:N2(g)+2O2(g)![]() 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol
2NO2(g)![]() O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol
则N2(g)+O2(g)![]() 2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
(2) 若反应N2(g)+O2(g)![]() 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
a.2υ正(N2)= υ逆(NO) b.混合气体密度不变
c.生成1molO2的同时生成2molNO d.混合气体平均相对分子质量不变
(3) 汽车尾气净化反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
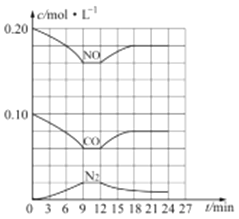
①该反应能自发进行的条件为_____ (填“高温”、“低温”或“任意温度”);
②在6~9 min 内,以CO 表示的平均反应速率 υ(CO)=________mol·L-l·min-1;
③第12min时改变的反应条件为_________ (填“升高温度”或“降低温度”);
④反应在第24min时的平衡常数K=____________(只列出计算式,无需计算结果),若保持温度不变,再向容器中充入CO、N2 各0.060mol,平衡将_________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。现进行如下图所示实验。下列有关说法正确的是

A. 步骤Ⅰ中减少的3 g固体一定是混合物
B. 步骤Ⅱ中质量减少的固体物质一定是Fe2O3
C. 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol
D. 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅的下列叙述中,错误的是 ( )
A.在自然界中,硅既能以游离态形式存在,又能以化合态形式存在
B.单质硅是良好的半导体材料
C.常温下,硅可以与氟气、强碱溶液起反应
D.晶体硅和金刚石具有类似的空间结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,P、M、N均是由这些元素组成的二元化合物,它们存在转化关系Q![]() P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是
P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是
A. 原子半径:Y>Z>W>X
B. 简单气态氢化物的热稳定性:Z>Y
C. Q既能与强酸溶液反应,又能与强碱溶液反应
D. Y的最高价氧化物对应的水化物与Q溶液混合,无M生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的HA和HB分别与0.10mol/L的NaOH溶液等体积混合,实验记录如下表:
实验编号 | 加入的酸 | 加入酸的浓度/(mol/L) | 混合后溶液的pH |
① | HA | 0.10 | 8.7 |
② | HB | 0.12 | 2 |
下列说法中正确的是
A. HA是强酸,HB是弱酸
B. 升高温度,溶液②中c(B-)/c(Na+)增大
C. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH->c(H+)
D. 溶液②中离子浓度的关系:c(Na+)+c(H++c(B-)=0.12 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使Na2S溶液中![]() 的比值变小,可采取的措施是( )
的比值变小,可采取的措施是( )
①加适量盐酸
②加适量NaOH(s)
③加适量KOH(s)
④加适量KHS(s)
⑤加水
⑥通H2S(g)
⑦加热.
A.②③④ B.①②⑤⑥⑦ C.②③ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com