
| A. | P-P键的键能大于P-Cl键的键能 | |
| B. | 可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H | |
| C. | Cl-Cl键的键能为 (b-a+5.6c)/4 kJ•mol-1 | |
| D. | 磷元素的非金属性比氯强 |
分析 A.依据P和Cl原子半径大小比较键长得到键能大小,键长越长,键能越小;
B.依据盖斯定律分析判断;
C.依据焓变=反应物键能之和-生成物键能之和计算分析;
D.P、Cl位于同一周期,同周期元素从左到右非金属性增强.
解答 解:A.原子半径P>Cl,因此P-P键键长大于P-Cl键键长,则P-P键键能小于P-Cl键键能,故A错误;
B.利用“盖斯定律”,结合题中给出两个热化学方程式可求出Cl2(g)+PCl3(g)=PCl5(g)△H=$\frac{b-a}{4}$KJ•mol-1,但不知PCl5(g)=PCl5(s)的△H,因此无法求出Cl2(g)+PCl3(g)=PCl5(s)的△H,故B错误;
C.利用Cl2(g)+PCl3(g)=PCl5(g)△H=$\frac{b-a}{4}$KJ•mol-1可得E(Cl-Cl)+3×1.2c-5c=$\frac{b-a}{4}$,因此可得E(Cl-Cl)=$\frac{b-a+5.6c}{4}$kJ•mol-1,故C正确;
D.P、Cl位于同一周期,同周期元素从左到右非金属性增强,非金属性Cl的较强,故D错误.
故选C.
点评 本题考查了反应热的计算、盖斯定律的应用等问题,为高频考点,题目难度中等,侧重于考查学生对反应热知识的综合应用能力,注意把握元素周期律、盖斯定律等知识的运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 单质硅常用作半导体材料 | |
| B. | 硅在自然界中只以化合态的形式存在 | |
| C. | SiO2与纯碱高温生成CO2,说明硅酸的酸性比碳酸强 | |
| D. | SiO2是非金属氧化物,它不与任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-2,3-二氯戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 2,4,6-三氯己烷 | D. | 3-甲基-3-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{10}^{22}$Ne和${\;}_{10}^{20}$Ne是同分异构体 | |
| B. | ${\;}_{10}^{22}$Ne和${\;}_{10}^{20}$Ne属于不同的核素 | |
| C. | ${\;}_{10}^{22}$Ne和${\;}_{10}^{20}$Ne的性质完全相同 | |
| D. | ${\;}_{10}^{22}$Ne转变为${\;}_{10}^{20}$Ne为化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
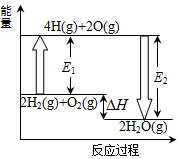 已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )| A. | 2H(g)→H2(g)△H>0 | B. | 图中E1=932kJ | ||
| C. | 图中E2=926 kJ | D. | 2H2(g)+O2(g)═2H2O(g)△H=-484 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料.结合联氨的结构判断下列说法正确的是( )
联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料.结合联氨的结构判断下列说法正确的是( )| A. | 联氨的晶体是原子晶体 | |
| B. | 联氨易溶于水 | |
| C. | 1 mol联氨分子中含有5NA个σ键和NA个π键 | |
| D. | 联氨分子是非极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com