
| 化学键 | H-H | O=O |
| 键能/KJ?mol-1 | 436 | 498 |
| A. | 463.4KJ/mol | B. | 926.8KJ/mol | C. | 221.6KJ/mol | D. | 413KJ/mol |
分析 水的结构式为H-O-H,2mol水分子中含有4molH-O键,2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol,反应物总键能-生成物总键能=反应热,据此计算O-H键的键能.
解答 解:水的结构式为H-O-H,2mol水分子中含有4molH-O键,2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol,反应物总键能-生成物总键能=反应热,则:436kJ/mol×2+498kJ/mol-4E(O-H)=-483.6KJ/mol,故E(O-H)=463.4kJ/mol,
故选A.
点评 本题考查反应热的有关计算,难度不大,注意掌握反应热与键能的关系,注意对基础知识的理解掌握.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
 超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某
超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,18gH2O中含有2NA个氢原子 | |
| B. | 标准状况下,22.4L H2O含有NA个H2O分子 | |
| C. | 1mol Na与足量水反应转移2NA个电子 | |
| D. | 0.1 mol•L-1CH3COOH溶液中含有0.1NA个CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
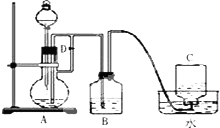 由于Fe(OH)2在空气中易被氧化,为了观察到白色的Fe (OH)2想了很多方法.
由于Fe(OH)2在空气中易被氧化,为了观察到白色的Fe (OH)2想了很多方法.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应情况设想 | 评价 |
| A | 当铁、铜均不剩余时,溶液中一定有Fe2+、Cu2+,一定无Fe3+ | 正确,Fe3+和Fe、Cu均可反应 |
| B | 当铁、铜均有剩余时,溶液中一定有Fe2+、Cu2+,无Fe3+ | 正确,Fe和Cu与Fe3+都反应,故有Fe2+和Cu2+,无Fe3+ |
| C | 当铜有剩余,铁无剩余时,溶液中一定只有Fe2+,无Cu2+ | 正确,Cu有剩余,故无Cu2+ |
| D | 当铁有剩余,铜无剩余时,溶液中一定有Fe2+、Cu2+ | 不正确,不可能有Fe剩余,而铜不剩余,因为Fe比Cu优先于Fe3+反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com