
【题目】氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。已知:锶与镁位于同主族:锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。

I.利用装置A和C制备Sr3N2
(1)实验装置中玻璃管之间需用橡皮管连接,其连接方法是先将___________,然后稍稍用力即可将玻璃管插入橡皮管。
(2)写出由装置A制备N2的化学反应方程式___________。
(3)装置A中a导管的作用是________。利用该套装置时,有同学提出应先点燃置A的酒精灯一段时间后,再点燃装置C的酒精灯,你同意其观点吗?_______(“同意”或“不同意”)。理由是___________。
Ⅱ.利用装置B和C制备Sr3N2。利用装置B从空气中提纯N2(已知:氧气可被连苯三酚溶液定量吸收)
(4)写出装置B的NaOH溶液中发生反应的离子方程式___________。
(5)装置C中广口瓶盛放的试剂是___________。
Ⅲ.测定Sr3N2产品的纯度
(6)取10.0g该产品,向其中加入适量的水,将生成的气体全部通入浓硫酸中,利用浓硫酸增重质量计算得到产品的纯度,该方法测得产品的纯度偏高,其原因是_______。经改进后测得浓硫酸增重1.02g,则产品的纯度为___________。
【答案】橡皮管和玻璃管润湿(只将其中之一润湿也给分) NH4Cl+NaNO2 ![]() N2↑+NaCl+2H2O 平衡气压,使液体顺利流下 同意 利用生成的N2将装置内空气排尽(或排尽装置内空气等) CO2+2OH-=CO32-+H2O 浓硫酸 未将气体中的水蒸气除去,也被浓硫酸吸收(或其它合理答案) 87.6%
N2↑+NaCl+2H2O 平衡气压,使液体顺利流下 同意 利用生成的N2将装置内空气排尽(或排尽装置内空气等) CO2+2OH-=CO32-+H2O 浓硫酸 未将气体中的水蒸气除去,也被浓硫酸吸收(或其它合理答案) 87.6%
【解析】
装置A中饱和氯化铵和亚硝酸钠反应生成N2,经过装置B处理后的氮气进入装置C中与锶反应生成氮化锶,结合锶和氮化锶的性质和实验的基本操作分析解答。
(1)实验装置中玻璃管之间需用橡皮管连接,连接橡皮管和玻璃管时,先将橡皮管和玻璃管润湿,然后稍稍用力即可将玻璃管插入橡皮管,故答案为:橡皮管和玻璃管润湿;
(2)装置A中饱和氯化铵和亚硝酸钠反应生成N2,反应的化学反应方程式为NH4Cl+NaNO2 ![]() N2↑+NaCl+2H2O,故答案为:NH4Cl+NaNO2
N2↑+NaCl+2H2O,故答案为:NH4Cl+NaNO2 ![]() N2↑+NaCl+2H2O;
N2↑+NaCl+2H2O;
(3)装置A是一个相对封闭的环境,a导管的存在,可以平衡气压,使饱和氯化铵溶液顺利流下。利用该套装置时,为了防止空气中的氧气与金属锶反应,实验时一个先点燃装置A的酒精灯一段时间后,再点燃装置C的酒精灯,故答案为:平衡气压,使液体顺利流下;同意;利用生成的N2将装置内空气排尽(或排尽装置内空气等);
(4) 利用装置B和C制备Sr3N2。利用装置B从空气中提纯N2,其中氧气可被连苯三酚溶液定量吸收,二氧化碳被氢氧化钠溶液吸收, NaOH溶液中发生反应的离子方程式为CO2+2OH-=CO32-+H2O,故答案为:CO2+2OH-=CO32-+H2O;
(5) 氮化锶遇水剧烈反应,进入装置C的氮气需要干燥,广口瓶盛放的试剂可以是浓硫酸,故答案为:浓硫酸;
(6)浓硫酸具有强烈的吸水性,生成的气体中含有一定量的水蒸气,未将气体中的水蒸气除去,也被浓硫酸吸收,导致测得氨气的质量偏大,造成测得的产品的纯度偏高;Sr3N2+6H2O=3Sr(OH)3+2NH3↑,取10.0g产品,向其中加入适量的水。将产生的气体全部通入到浓硫酸中,浓硫酸增重1.02g,为氨气质量,氨气的物质的量=![]() =0.06mol,则n(Sr3N2)= 0.03mol,产品纯度=
=0.06mol,则n(Sr3N2)= 0.03mol,产品纯度=![]() ×100%=87.6%,故答案为:未将气体中的水蒸气除去,也被浓硫酸吸收;87.6%。
×100%=87.6%,故答案为:未将气体中的水蒸气除去,也被浓硫酸吸收;87.6%。


科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数 | 待测液体积 | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时,KMnO4溶液应装在 (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水的电离平衡曲线如右图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25 ℃)________KW(100 ℃)(填“>”、“<”或“=”)。

(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为____ ___。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国内最新研究,实现CO2的固定和储能的多功能电化学反应装置,如图所示。该装置充放电过程并不完全可逆,即充电过程C不参与反应。放电过程反应方程式为:4Li+3CO2=2Li2CO3+C,下列叙述正确的是
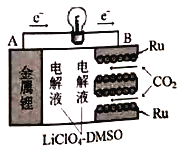
A. 放电过程正极反应式为4Li++3CO2+4e-=2Li2CO3+C
B. 若放电过程转移电子物质的量为0.2mol,理论上可以固定C的质量为1.2g
C. 充电过程B电极为阴极,发生氧化反应
D. 可用 LiClO4水溶液代替LiClO4-DMSO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)明矾净水原理___________________________________(离子方程式表示),胶体具有________________性。
(2)在25℃时,将pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为___________
(3)NH4Cl溶液显______________(填“酸性”、“中性”或“碱性”),理由是_________(用离子方程式或必要的文字说明).
(4)NaHCO3溶液中,下列表述正确的是_______
A.c(Na+) + c(H+)= c(HCO3﹣)+ c(CO32﹣)+ c(OH﹣)
B. c(OH﹣)= c(H2CO3)+ c(H+)-c(CO32﹣)
C.c(OH﹣)= c(HCO3﹣)+ c(H+)+c(H2CO3)
D.c (Na+)= c(HCO3﹣)+ c(CO32﹣) + c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W在工业上常用作溶剂和香料,其合成方法如图,下列说法不正确的是

A. M、N、W均能发生加成反应和取代反应
B. N、W组成上相差一个CH2原子团,所以互为同系物
C. 1molM与1molw完全燃烧消耗O2的物质的量相同
D. M苯环上的二氯代物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成治疗心血管疾病药物的中间体,可通过以下途径合成:

已知:① (苯胺易被氧化)
(苯胺易被氧化)
②甲苯发生一硝基取代反应与A类似。
回答下列问题:
(1)写出C中官能团的名称:___________。
(2)写出有关反应类型:B![]() C _______;F
C _______;F![]() G______ o
G______ o
(3)写出A![]() B的反应方程式:___________ 。
B的反应方程式:___________ 。
(4)写出同时满足下列条件D的所有同分异构体的结构简式:_______________
①能发生银镜反应
②能发生水解反应,水解产物之一与FeCl3溶液反应显紫色
③核磁共振氢谱(1![]() 显示分子中有4种不同化学环境的氢
显示分子中有4种不同化学环境的氢
(5)合成途径中,C转化为D的目的是___________________
(6)参照上述合成路线,以甲苯和![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备 的合成路线。__________
的合成路线。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离方程式:H2O![]() H++OH-。下列叙述中,正确的是
H++OH-。下列叙述中,正确的是
A. 升高温度,Kw增大,pH不变
B. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C. 向水中加入少量硫酸,c(H+)增大,Kw不变
D. 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com