
【题目】NH3是一种重要的化工原料,可用来制备肼、硝酸、硝酸铵和氯胺等。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2![]() 2NH3,测得平衡体系中NH3的物质的量分数如右图。
2NH3,测得平衡体系中NH3的物质的量分数如右图。
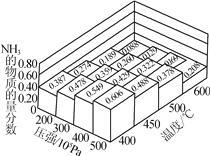
① 下列途径可提高氨气产率的是________(填字母)。
a. 采用常温条件 b. 采用高温条件
c. 将原料气加压 d. 将氨液化,不断移去液氨
② 右图中所示的平衡体系中NH3的物质的量分数为0.549和0.478时,该反应的平衡常数分别为K1、K2,则K1________(填“>”“<”或“=”)K2。
(2)肼(N2H4)是一种火箭燃料。已知:
N2(g)+2O2(g)===2NO2(g);ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g);ΔH=-534.0 kJ·mol-1
NO2(g)===1/2N2O4(g);ΔH=-28.0 kJ·mol-1
① 反应2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)的ΔH=________kJ·mol-1。
② 氨气与次氯酸钠溶液反应生成肼的离子方程式为__________________________。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如右图。

① 阴极的电极反应式为____________________________________。
② 将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为________。
(4)饮用水消毒时,氯胺(NH2Cl等)在酸性条件下具有良好的效果(已知:NH2Cl+H2O≒NH3+HClO),其原因是__________________________________________。
【答案】 cd = -1 079.7 2NH3+ClO-===Cl-+N2H4+H2O NO+5e-+6H+===NH![]() +H2O 1∶4 氯胺与水反应存在平衡:NH2Cl+H2O ≒ NH3+HClO,酸性条件下平衡右移使次氯酸浓度变大
+H2O 1∶4 氯胺与水反应存在平衡:NH2Cl+H2O ≒ NH3+HClO,酸性条件下平衡右移使次氯酸浓度变大
【解析】试题分析:(1)① 平衡正向移动可提高氨气产率;②物质的量分数为0.549和0.478时对应的温度都是400℃;(2)① 根据盖斯定律计算2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)的焓变;②根据氧化还原反应规律书写氨气与次氯酸钠溶液反应生成肼的离子方程式;(3)① 阴极得电子发生还原反应,所以阴极产物是NH![]() ;②电解总反应是8NO+7H2O=== 3NH4NO3+2HNO3,根据电解总反应分析通入氨气的物质的量; (4)酸性条件下NH2Cl+H2O ≒ NH3+HClO平衡正向移动。
;②电解总反应是8NO+7H2O=== 3NH4NO3+2HNO3,根据电解总反应分析通入氨气的物质的量; (4)酸性条件下NH2Cl+H2O ≒ NH3+HClO平衡正向移动。
解析:(1)①采用常温条件,反应速率慢,故a错误; b. 采用高温条件,平衡逆向移动,氨气的产率降低,故b错误; c. 将原料气加压,平衡正向移动,氨气的产率增大,故c正确; d. 将氨液化,不断移去液氨,平衡正向移动,氨气产率增大,故d正确;②物质的量分数为0.549和0.478时对应的温度都是400℃,温度相同,平衡常数相同,故K1=K2;
(2)①N2(g)+2O2(g)===2NO2(g);ΔH=+67.7 kJ·mol-1
②N2H4(g)+O2(g)===N2(g)+2H2O(g);ΔH=-534.0 kJ·mol-1
③NO2(g)===1/2N2O4(g);ΔH=-28.0 kJ·mol-1
根据盖斯定律②×2-③×2-①得2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 079.7 kJ·mol-1;②根据氧化还原反应规律,氨气与次氯酸钠溶液反应生成肼和氯离子,离子方程式是2NH3+ClO-===Cl-+N2H4+H2O;(3)① 阴极得电子发生还原反应,所以阴极产物是NH![]() ,阴极反应式是NO+5e-+6H+===NH
,阴极反应式是NO+5e-+6H+===NH![]() +H2O;②电解总反应是8NO+7H2O=== 3NH4NO3+2HNO3,根据电解总反应将电解生成的HNO3全部转化为NH4NO3,则通入的NH3为2mol,所以通入的NH3与实际参加反应的NO的物质的量之比至少为2:8=1:4; (4)酸性条件下NH2Cl+H2O ≒ NH3+HClO平衡正向移动,使次氯酸浓度变大。
+H2O;②电解总反应是8NO+7H2O=== 3NH4NO3+2HNO3,根据电解总反应将电解生成的HNO3全部转化为NH4NO3,则通入的NH3为2mol,所以通入的NH3与实际参加反应的NO的物质的量之比至少为2:8=1:4; (4)酸性条件下NH2Cl+H2O ≒ NH3+HClO平衡正向移动,使次氯酸浓度变大。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】某学生利用物质间的互变,设计成一个平面魔方,如图所示: 
已知:
①A、B、C、D、G含有同种元素.
②E 是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.B具有氧化性,液显黄色,能将SO2氧化为F(H2SO4),F与A反应生成E、G.
③
纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
颜色 | 银白色(粉末状时为黑色)黄色红 | 褐色 | 红棕色 | 浅绿色 |
依据以上信息填空:
(1)请写出E的电子式 .
(2)D的化学式 .
(3)请写出ABCDG所含的同种元素的原子结构示意图 .
(4)G生成C的过程中所出现的现象为
(5)写出A→B化学方程式:
(6)B→F的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C是中学化学常见物质,它们在一定条件下有如下转化关系 ![]()
(1)若A是一种淡黄色固体,B是造成酸雨的“罪魁祸首”.则X的化学式为 .
(2)若A一种黄绿色气体,X是生活中使用最广泛的一中金属.则B与金属Cu反应的离子方程式为 .
(3)若A是无色有刺激性气味的气体,B在空气中会立即转变为红棕色,则 A气体与X反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是( )
A.用电子式表示氢溴酸的形成过程为: ![]()
B.乙烯的结构简式:C2H4
C.四氯化碳的电子式为: ![]()
D.质子数为27、中子数为33的Co原子: ![]() Co
Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g)2N2(g)+6H2O(g),现向一容积不变的2L密闭容器中充入4mol NH3和3mol O2 , 4min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是( )
A.v(O2)=0.225 molL﹣1min﹣1
B.v(H2O)=0.375 molL﹣1min﹣1
C.v(N2)=0.125 molL﹣1min﹣1
D.v(NH3)=0.250 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
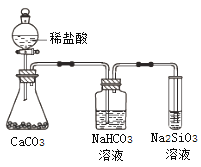
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阿伏加德罗常数的值为NA。下列说法正确的是
A. 常温下,14 g的![]() C含中子数目为6NA
C含中子数目为6NA
B. 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L
C. 用铂电极电解100 mL 1 mol L-1的CuSO4溶液足够长时间,转移电子数一定为0.2NA
D. 标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com