
【题目】雾霾严重影响人们的生活,雾霾的形成与汽车排放的 NOx等有毒气体有关.
(1)可以通过活性炭处理汽车尾气,原理为:C(s)+2NO(g)N2(g)+CO2(g)△H<0.
①下列情况能说明该反应达到平衡状态的是
A.2ν正(NO)=ν逆(CO2)
B.在恒温、恒容的容器中,混合气体的压强保持不变
C.在绝热、恒容的容器中,反应的平衡常数不再变化
D.在恒温、恒压的容器中,混合气体的密度保持不变
②在恒温、恒容条件下,加入2mol C(s)和2mol NO(g)达平衡后,再在绝热、恒容条件下,加入1mol NO重新达平衡后,N2的百分含量将(填“增大”、“减小”、“不变”).
(2)臭氧是理想的烟气脱硝试剂,原理为:2NO2(g)+O3(g)N2O5(g)+O2(g).
若在容积为10L的密闭容器中进行该反应,起始时充入0.4molNO2、0.2mol O3 , 反应在不同条件下进行,反应体系总压强随时间的变化如图1所示.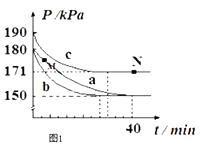
①实验a从开始至平衡时的反应速率v(O3)=;实验c中NO2的平衡转化率为 .
②与实验a相比,其他两组改变的实验条件分别是:b , c .
③M点的逆反应速率 v(逆)N点的正反应速率v(正) (填“>”、“<”或“=”).
④若在N点时,维持温度和压强不变,t1时再加入0.4molNO2、0.2mol O3 , 请在图中画出逆反应速率在t1后随时间t的变化曲线图2 . 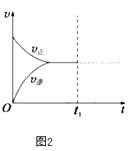
【答案】
(1)CD;减小
(2)2.5×10﹣4mol?L﹣1?min﹣1;30%;使用催化剂;升高温度;<;
【解析】解:(1)C(s)+2NO(g)N2(g)+CO2(g)△H<0.①A.当ν正(NO)=2ν逆(CO2)时该反应达到平衡状态,所以2ν正(NO)=ν逆(CO2)时该反应没有达到平衡状态,故错误;
B.该反应前后气体物质的量不变,所以在恒温、恒容的容器中,混合气体的压强始终保持不变,不能判断该反应是否达到平衡状态,故错误;
C.在绝热、恒容的容器中,反应的平衡常数不再变化,说明该反应正逆反应速率相等,该反应达到平衡状态,故正确;
D.在恒温、恒压的容器中,反应前后气体的质量发生变化,当混合气体的密度保持不变时,该反应达到平衡状态,故正确;
故选CD; ②加入NO后平衡正向移动,但转化的NO物质的量远远小于加入的NO,导致混合气体中氮气增加的物质的量远远小于总物质的量增加的量,所以氮气含量减小,所以答案是:减小;(2)①同温同容下,混合气体的压强之比等于其物质的量之比,开始时压强为180kPa,平衡时为150kPa,所以反应前后气体的物质的量之比=180kPa:150kPa=6:5,反应前气体的总物质的量=(0.4+0.2)mol=0.6mol,则反应后气体的总物质的量为0.5mol,根据2NO2(g)+O3(g)N2O5(g)+O2(g)知,反应前后减少的物质的量等于臭氧参加反应的物质的量为(0.6﹣0.5)mol=0.1mol,
臭氧平均反应速率v= ![]() =
= ![]() =2.5×10﹣4 molL﹣1min﹣1;
=2.5×10﹣4 molL﹣1min﹣1;
实验c中,反应前压强与反应前后压强变化量之比等于反应前气体的物质的量与反应前后气体的物质的量变化量之比=190pKa:(190﹣171)pKa=10:1,反应前气体的总物质的量=(0.4+0.2)mol=0.6mol,则前后气体减少的物质的量为0.06mol,参加反应的二氧化氮物质的量是反应前后减少的物质的量的2倍,为0.12mol,
二氧化氮转化率= ![]() =
= ![]() ×100%=30%;
×100%=30%;
所以答案是:2.5×10﹣4 molL﹣1min﹣1;30%;
②与实验a相比,b中缩短到达平衡的时间,但平衡时压强不变,说明改变条件只改变反应速率但不影响平衡移动,所以改变的条件是使用催化剂;
c中改变条件时增大反应速率且反应前后压强改变量变小,抑制平衡正向移动,所以改变的条件是升高温度;
所以答案是:使用催化剂;升高温度;③温度越高、压强越大反应速率越大,但温度对化学反应速率影响大于压强对化学反应速率影响,N点温度高于M点,所以M点的逆反应速率 v(逆)<N点的正反应速率v(正),所以答案是:<;④若在N点时,维持温度和压强不变,t1时再加入0.4molNO2、0.2mol O3 , 改变条件瞬间,反应物浓度不变、生成物浓度变小,平衡正向移动,其图象为 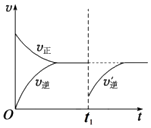 ,所以答案是:
,所以答案是: 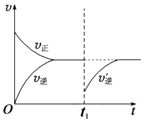 .
.
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征和化学平衡状态的判断的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


科目:高中化学 来源: 题型:
【题目】试回答下列各题: 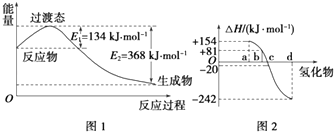
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJmol﹣1
请填空:
共价键 | H﹣H | Cl﹣Cl | H﹣Cl |
键能/(kJmol﹣1) | 436 | 247 |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式: .
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25kJmol﹣1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=﹣47kJmol﹣1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJmol﹣1③
请写出CO还原FeO的热化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示AlCl3溶液与NaOH溶液相互滴加混合,由图中判断错误的是( )

A. ①线表示Al3+物质的量的变化
B. x表示AlCl3的物质的量
C. ③线表示Al(OH)3物质的量的变化
D. ④线表示AlO![]() 物质的量的变化
物质的量的变化
【答案】B
【解析】假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗![]() molAl3+,生成
molAl3+,生成![]() molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: ![]() mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,选项A正确;B.由上述分析可知,x表示NaOH溶液,选项B错误;C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,后减小,故②③线表示Al(OH)3的物质的量的变化,选项C正确;D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,选项D正确。答案选B。
mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,选项A正确;B.由上述分析可知,x表示NaOH溶液,选项B错误;C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,后减小,故②③线表示Al(OH)3的物质的量的变化,选项C正确;D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,选项D正确。答案选B。
点睛:本题考查镁铝重要化合物、离子反应、化学计算等,根据相互滴加过程离子物质的量的变化确定图象表示向AlCl3溶液中滴加NaOH溶液是解题的关键。假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗![]() molAl3+,生成
molAl3+,生成![]() molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: ![]() mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
【题型】单选题
【结束】
17
【题目】(1)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
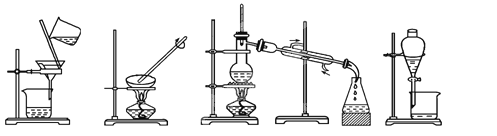
① ② ③ ④
从海水中提取水:____________;从KCl溶液中获取KCl晶体:____________;
分离CaCO3和水:____________;分离植物油和水:____________。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
实验① | 实验② | 实验③ | |
取甲瓶溶液的量 | 400 mL | 120 mL | 120 mL |
取乙瓶溶液的量 | 120 mL | 440 mL | 400 mL |
生成沉淀的量 | 1.56 g | 1.56 g | 3.12 g |
①甲瓶溶液为________溶液。
②乙瓶溶液为________溶液,其物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)溶液中,c(H+)=10﹣x molL﹣1 , c(OH﹣)=10﹣y molL﹣1 , x与y的关系如图1所示. 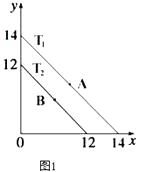
①若从A点到B点,可采取的措施为
②T2℃时,将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,则水电离出的c(OH﹣)将(填“增大”、“减小”、“不变”).
③已知:T1℃时,醋酸的电离常数为 1.8×10﹣5 , 则 T1℃时,在 0.5molL﹣1的醋酸溶液中由醋酸电离出的 c(H+)约是水电离出的 c(H+)的倍 .
④T2℃时,将某溶液(此溶液满足 lg[ ![]() ]=10)滴入含 Na+、HS﹣、SO42﹣、K+的溶液中,发生反应的离子方程式为 .
]=10)滴入含 Na+、HS﹣、SO42﹣、K+的溶液中,发生反应的离子方程式为 .
(2)体积均为1mL pH=2的一元酸HA和HB,加水稀释过程中pH与溶液体积关系如图2所示: 
①m的取值为 .
②a点酸的浓度b点酸的浓度(填“>”、“<”、“=”).
③若 m<4,常温下a点到c点的过程中,下列表达式的数据变大的是 .
A.c(A﹣) B.n(H+)n(OH﹣) C. ![]() D.
D. ![]()
(3)已知:25℃时,HCN、H2CO3 的电离平衡常数分别为K=4.9×10﹣10 , K1=4.3×10﹣7、K2=5.6×10﹣11 , 向NaCN溶液中通入少量CO2 , 所发生反应的离子方程式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将7.8克镁和铝的混合粉末溶于900ml浓度为1mol/L的盐酸中,完全反应可收集到标准状况下气体8.96升,向反应后的混合溶液中逐滴加入2mol/L的氢氧化钠溶液,试计算:
(1)原金属混合物中含铝克;
(2)当加入ml氢氧化钠溶液时,Mg2+、Al3+恰好完全沉淀;
(3)当再加入ml氢氧化钠溶液时,Al(OH)3恰好完全溶解,此时可得沉淀克.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染已成为人类社会面临的重大威胁,下列对应关系不正确的是
环境问题 | 主要污染物 | 环境问题 | 主要污染物 | ||
A | 酸雨 | 二氧化硫 | C | 白色污染 | 二氧化硅 |
B | 温室效应 | 二氧化碳 | D | 光化学烟雾 | 二氧化氮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0L恒容密闭容器中充入2molSO2和1molO2 , 发生反应:2SO2(g)+O2(g)2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1s的平均速率v(O2)=0.4/t1molL﹣1s﹣1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.保持温度不变,向该容器中再充入0.3 molSO2、0.1molO2和0.2molSO3 , 则此时V正>V逆
D.相同温度下,起始时向容器中充入4mol SO3 , 达到平衡时,SO3的转化率大于10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加NaOH溶液(c=0.1mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy , 则( ) 
A.x为弱酸,Vx<Vy
B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy
D.y为强酸,Vx>Vy
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com