
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A. CO2和H2O B. CCl4和KCl C. NaCl和HCl D. SO2和SiO2
科目:高中化学 来源: 题型:
【题目】下列实验步骤是兴趣小组对某混合样品含量的测定,样品成分为FeO、FeS2、SiO2、及其它杂质,杂质不与酸碱反应,受热稳定。(步骤中所加试剂均为足量)
①称量mg样品灼烧。装置如下:
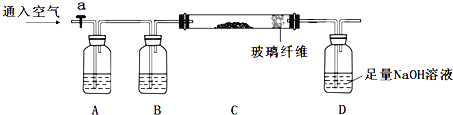
②D瓶溶液![]()
![]()
![]() 固体(ag)
固体(ag)
③![]()
请回答下列问题:
(1)连接好仪器后,如何检查整套装置的气密性_______________。
(2)A瓶内所盛试剂是__________溶液。灼烧完成后熄灭酒精灯,若立即停止通空气,可能对实验的影响是(写两点) _________________________。
(3)步骤②中加入双氧水的离子方程式为____________________。若此步骤不加入双氧水对测定硫元素含量的影响是_____________(填“偏高”、“偏低”或“无影响”)。
(4)连续操作1为_________、洗涤、_________、称量;连续操作2为洗涤、_________、称量。
(5)从步骤③的bg滤渣入手,可测定SiO2的含量,下面各组试剂中不适合测定的是___________。
A.NaOH溶液 、稀硫酸 B.Ba(OH)2溶液、盐酸 C.氨水、稀硫酸 D.NaOH溶液、盐酸
(6)求样品中FeO的质量分数(列出算式即可)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g) ![]() SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:
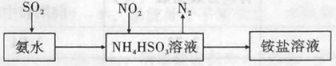
NO2被吸收的离子方程式是 。
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
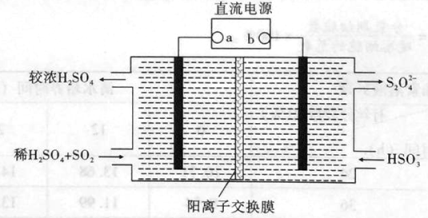
①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体分子中的极性键在红外线的照射下,易像弹簧一样做伸缩和弯曲运动,从而产生热量而造成温室效应.下列不属于造成温室效应气体的是( )
A. CO2 B. N2O C. CH4 D. N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的化学资源库,下列有关海水综合利用说法正确的是
A.海水的淡化,必须经过化学变化才能得到
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备金属Na
D.利用海水、铝、空气的航标灯的原理是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍。请回答下列问题:
(1)Y基态原子的价电子排布图为 ,其第一电离能在同周期元素中由大到小排第 位。
(2)W的元素名称为 ,其基态原子核外有 种空间运动状态不同的电子。
(3)R的中心原子采取的杂化方式为 ,写出R的一个等电子体: 。(填化学式)。
(4)Z与Y在一定条件下可形成高硬度的化合物,该化合物的晶体类型为 ,其由Z、Y构成的最小环为 元环。
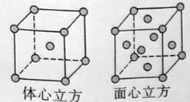
(5)W的单质在900℃以下为α型体心立方晶胞,910℃以上W转变为γ型面心立方晶胞,晶胞结构分别如图所示。两种晶体中距离最近的铁原子间距离相同。则在800℃和1000℃下,铁的密度之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1)现有如下两个反应:
A.NaOH + HCl = NaCl + H2O
B.2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质判断, 能设计成原电池(填“A”或“B”)。
②如果(A或B)不能,说明其原因 .
2)研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:_____________。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
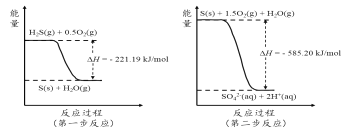
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:

质子的流动方向为___________(“从A到B”或“从B到A”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为________________________;
(2)A与溴的四氯化碳溶液反应的化学方程式为____________________________。
(3)已知:![]()
![]()
![]() 。 请写出A与稀、冷的KMnO4溶液
。 请写出A与稀、冷的KMnO4溶液
在碱性条件下反应生成物的结构简式__________________________________;
(4)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%。写出此化合物的结构简式______________________________;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com