
氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
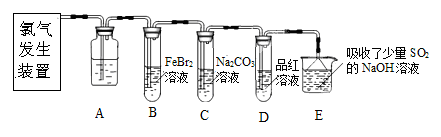
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有
;
(2)装置A中盛有的试剂是 ,作用是 。
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是 (填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32- 和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设。假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-。
(5)学习小组判断同时存在SO32-和ClO-是不可能的理由是 。
38.现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol/L H2SO4
b.0.01 mol/L KMnO4
c.1 mol/L BaCl2溶液
d.淀粉碘化钾溶液
e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B
两试管中。
步骤二:向A试管中滴加少量___________ (填序号),若溶液_________________(填现象),则假设
1成立。
步骤三:向B试管中滴加少量___________(填序号),若溶液_________________(填现象),则假设2
成立。
(1)分液漏斗,酒精灯 (各1分,共2分)
(2)饱和食盐水,除去氯气中的氯化氢 (各1分,共2分)
(3)2Fe2+ + 4Br-+ 3Cl2 →2Fe3+ + 6 Cl-+ 2 Br 2 (2分)
(4)实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取。(1分)
(5)SO32-和ClO-因发生氧化还原反应,故不能共存 (1分)
38. b ,褪色 ;d ,变蓝色 (各1分,共4分)
【解析】
试题分析:(1)二氧化锰和浓盐酸反应制取氯气的方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,从方程式可知该反应需加热,因此需酒精灯,反应物浓盐酸的滴加以及防氯气的逸出还需要分液漏斗。
MnCl2+Cl2↑+2H2O,从方程式可知该反应需加热,因此需酒精灯,反应物浓盐酸的滴加以及防氯气的逸出还需要分液漏斗。
(2)由于浓盐酸易挥发,所以生成的氯气中含有氯化氢杂质,所以当含氯化氢的氯气通过饱和食盐水时,氯化氢溶解在其中,氯气几乎不溶,这样可以除去氯气中的氯化氢杂质。
(3)氯气溶于水生成的次氯酸具有漂白性,所以若D中品红溶液褪色,说明经过D中有氯气,经过D中有氯气说明B装置中,溴化亚铁中的二价铁和溴离子均被氧化,发生反应的离子方程式为2Fe2++4Br-+3Cl2→2Fe3++6Cl-+2Br2。
(4)由于亚铁离子的还原性强于溴离子的,所以FeBr2与Cl2发生氧化还原反应时,溴化亚铁中的二价铁先被氧化,所以只须证明有三价铁存在即可。KSCN溶液可与三价铁形成血红色的硫氰化铁可证明有三价铁存在。另外也可以证明有溴单质生成,因此正确的操作应该是实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取。
(5)ClO-中+1价的氯具有强氧化性,SO32-中+4价的硫具有还原性,ClO-与SO32-会发生氧化还原反应,所以二者不能大量共存。
38.步骤二 中KMnO4 具有强氧化性与具有还原性的SO32-发生氧化还原反应KMnO4褪色;步骤三中ClO-中+1价的氯具有强氧化性,能将碘化钾中-1价的碘氧化成碘单质.淀粉遇到碘单质显蓝色。
考点:考查氯气的制备、除杂、性质探究、物质检验以及实验方案设计与评价等


科目:高中化学 来源: 题型:阅读理解
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com