
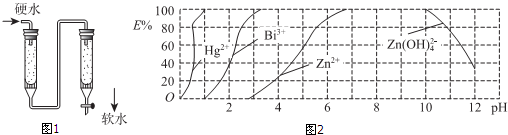
分析 (1)具有暂时硬度的水经加热煮沸后,钙、镁离子转化为沉淀;CaSO4与纯碱碳酸钠发生复分解生成难溶的碳酸钙沉淀;碳酸钙与盐酸反应生成氯化钙、二氧化碳和水;
(2)K2FeO4具有强氧化性,可用于杀菌消毒,可生成Fe(OH)3,具有吸附性;当水的酸性或碱性较强时均不利于形成Fe(OH)3胶体;
(3)硬水转化为软水,所以是阳离子交换柱;依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(4)①由图可知:当废水的pH=4时,废水中能以简单金属离子形式存在的离子是锌离子;
②当水中n(Bi3+):n[Bi(HDz)3]=3:2时,也就是属离子以络合物形式被萃取分离的百分率为40%,对就废水的pH=2;
③向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为Bi(HDz)3+6OH-=Bi(OH)3↓+3H2O+3Dz2-.
解答 解:(1)暂时硬度水与永久硬度水煮沸后会出现白色固体的是暂时硬度;CaSO4与纯碱碳酸钠发生的离子方程式为:CaSO4+CO32-=CaCO3+SO42-;碳酸钙与盐酸反应生成氯化钙、二氧化碳和水的离子反应方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:暂时硬度;CaSO4+CO32-=CaCO3+SO42-;CaCO3+2H+=Ca2++H2O+CO2↑,;
(2)K2FeO4具有强氧化性,可用于杀菌消毒,可生成Fe(OH)3,具有吸附性,可除去水的悬浮性杂质,当水的酸性或碱性较强时均不利于形成Fe(OH)3胶体;
故答案为:高铁酸钾有强氧化;当水的酸性或碱性较强时均不利于形成Fe(OH)3胶体;
(3)硬水转化为软水,所以是阳离子交换柱;某天然水中c(Ca2+)=1×10-3mol•L-1硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1×10-3mol,相当于CaO质量=1×10-3mol×56g/mol=56mg/L<450mg/L,故答案为:阳;符合,1.0×10-3mol/L×56g/mL×103mg/g×1L=56mg/L<450mg/L;
(4)①由图可知:当废水的pH=4时,废水中能以简单金属离子形式存在的离子是锌离子,故答案为:Zn2+;
②当水中n(Bi3+):n[Bi(HDz)3]=3:2时,也就是属离子以络合物形式被萃取分离的百分率为40%,对就废水的pH=2,故答案为:2;
③向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为Bi(HDz)3+6OH-=Bi(OH)3↓+3H2O+3Dz2-,故答案为:Bi(HDz)3+6OH-=Bi(OH)3↓+3H2O+3Dz2-.
点评 本题主要考查了学生分析问题、解决问题的能力,紧扣习题中的信息是解答本题的关键,难度中等.


科目:高中化学 来源: 题型:解答题
 ,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 可以表示二氧化碳分子 可以表示二氧化碳分子 | |
| B. | S2-的结构示意图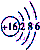 | |
| C. | 电子式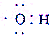 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| D. | 光气((COCl2)结构式: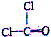 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 向20mL1mol/L的FeBr2溶液中通入0.02molCl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 向漂白粉溶液中通入少量的SO2:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO | |
| D. | 单质钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | (NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 | |
| B. | 苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为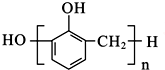 | |
| C. | 醋酸和硬脂酸互为同系物,C6H12和C9H18也一定互为同系物 | |
| D. | 迷迭香酸的结构为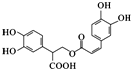 它可以发生酯化、水解但不能加成反应. 它可以发生酯化、水解但不能加成反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 原子半径:X>Y>Z | D. | 原子最外层电子数:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;加聚反应;
;加聚反应;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com