
【题目】[化学——选修3:物质结构与性质]
X、Y、Z、W、Q为前四周期的五种元素,且原子序数依次增大。已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W和元素Z为同族元素,Q的最外层电子数为2,次外层电子数等于Y和W2 -最外层电子数之和,根据以上信息回答下列问题:
(1)上述五种元素中电负性最大的是___(填元素符号,下同),Y的第一电离能大于Z的第一电离能原因___________________________________。
(2)XW2的电子式为______________。
(3)Q的价电子排布式为_____________,Y3-的分子构型为______________。
(4)下列关于WZ2结构的说法正确的是___________(填序号)。
a.WZ2为直线形非极性分子 b.WZ2为直线形极性分子
c.WZ2中W为sp3杂化 d.WZ2中W为sp2杂化
(5) W有两种常见的含氧酸,较高价的酸性比较低价的______,理由______________。
(6)α-QW的晶胞是立方体,用X射线衍射法测得该晶体晶胞边长=520.0pm,26℃测得该晶体的密度为4.1g/cm3,请列式计算一个晶胞中含有的Q、W离子数。(5.23≈140.6)
【答案】(1)N,原子最外层2p轨道半充满,能量低,所以稳定;
(2)![]() ;(3)3d54s2 ,直线型;
;(3)3d54s2 ,直线型;
(4)d;
(5)强,S的正电性越高,导致S-O-H中O的电子向S偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强;
(6)4,4。
【解析】试题分析:形成XW2,常见的为CO2、SO2、CS2,根据X、Y、Z、W原子序数增大,且均为非金属,因此XW2为CS2,X:C,W:S,W和Z同主族,则Z:O,Y:N,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,则Q为Mn,
(1)同周期从左向右电负性增大,根据洪特规则特例,ⅡA>ⅢA,ⅤA>ⅥA,因此电负性最大的是N,原子最外层2p轨道半充满,能量低,所以稳定;
(2)XW2为CS2,S和O同主族,性质形似,CO2为直线型,则CS2为直线型,其电子式为:![]() ;(3)Q为Mn,属于过渡元素,其价电子是最外层和次外层d能级,即3d54s2 ,等电子体的空间构型相同,CS2为直线型,则N3-为直线型;
;(3)Q为Mn,属于过渡元素,其价电子是最外层和次外层d能级,即3d54s2 ,等电子体的空间构型相同,CS2为直线型,则N3-为直线型;
(4)SO2有2个σ键,孤电子对数为(6-2×2)/2=1,价层电子对数为3,构型为V形,极性分子,价层电子对数等于杂化轨道数,即S的杂化类型为sp2,故选项d正确;
(5)S的两种含氧酸为H2SO3、H2SO4,最高价含氧酸的酸性强于低价含氧酸的酸性,S的正电性越高,导致S-O-H中O的电子向S偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强;
(6)QW化学式为MnS,根据ρ=m/v,m=N/NA,V=(520×10-24)3,解得N=4,即离子数为4。


科目:高中化学 来源: 题型:
【题目】将CO2转化为甲醇的原理为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
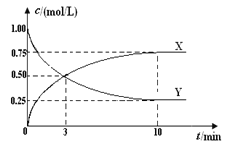
A.曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B.从反应开始到10min时,H2的反应速率υ(H2)=0.225 mol/(L·min)
C.平衡时H2 的转化率为75%
D.500 ℃时该反应的平衡常数K=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 请回答:
(1)HClO的结构式 。
(2)明矾可用来净水,用离子方程式表示其理由 。
(3)MgCO3悬浊液经煮沸可转化为更难溶的Mg(OH)2,转化的化学方程式是 。
(4)完成以下氧化还原反应的离子方程式:
( )Fe3+ + ( )Cl2+ = ( )FeO42- + ( )Cl- +
II 盐湖提锂脱镁渣主要成分为Mg(OH)2、Li2CO3和少量CaCO3,利用盐湖提锂脱镁渣制备高纯轻质氧化镁,为盐湖镁资源综合回收利用提供了一条可行途径,生产流程如图所示:

回答下列问题:
(1)固体A的成分是 。
(2)固体A在真空、1200℃条件下与硅单质反应生成金属镁,反应的化学方程式为 。
(3)沉淀物X中存在Mg5(CO3)4(OH)2·4H2O,则盐湖提锂脱镁渣与NH4HCO3溶液反应生成Mg5(CO3)4(OH)2·4H2O的化学方程式是 。
(4)实际生产中NH4HCO3与Mg(OH)2等物质的量之比要比(3)中反应理论值大的原因是
。
(5)欲检验沉淀物X是否煅烧完全,请设计简要的实验方案:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】央视曝光某品牌食品在生产中使用“瘦肉精”猪肉。瘦肉精(Clenbuterol)是一种廉价药品,学名盐酸克伦特罗。它对于减少脂肪增加瘦肉作用非常好,但它有很危险的副作用,轻则导致心律不整,重则导致心脏病.盐酸克伦特罗的结构简式如图.下列有关说法错误的是

A.该有机物H-NMR谱有7个峰
B.该有机物的分子式为C12H17N2Cl2O
C.该有机物中含有2个手性碳原子
D.该有机物能发生加成反应、取代反应、氧化反应和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为

下列说法正确的是
A. 可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B. 香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应
C. 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D. 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用乳酸钙和FeCl2为原料生产乳酸亚铁([CH3CH(OH) COO]2Fe·3H2O) 和医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3% ~99.3%),制备流程如下:

(1)实验室常用两种方案制备FeCl2,写出原子利用率为100%的反应的化学方程式 ;在FeCl2溶液中需要加
(2)制备乳酸亚铁晶体是向乳酸钙溶液中加入过量的FeCl2溶液,写出该反应的化学方程式 。
(3)操作1、操作2、操作3依次为 、 、 。
(4)向“滤液a”中先加H2O2溶,作用是 。然后再调节溶液
的 pH 约为5,目的是 。
(5)向“滤液b”加盐酸的目的是 。
(6)为测定样品中CaCl2·2H2O的含量,称取0.7600g样品并配成250mL 溶液,各取该溶液 25.00mL,分别置于三个锥形瓶中,用0.05000mol·L -1 AgNO3溶液进行三次滴定,消耗AgNO3溶液的平均体积为20.39mL。计算样品中CaCl2·2H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是

①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A.①②③ B.①②⑤ C.①②⑤⑥ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将纯Fe棒和石墨棒插入1L饱和NaCl溶液中。下列说法正确的是( )

A.M连接电源正极,N连接电源负极,当两极产生气体总量为22.4mL(标准状况)时,则生成0.001molNaOH
B.去掉电源,将M、N用导线直接相连,在溶液中滴入酚酞试液,C电极周围溶液变红
C.M连接电源负极,N连接电源正极,如果把烧杯中的溶液换成1LCuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀
D.M连接电源正极,N连接电源负极,将C电极换成Cu电极,电解质溶液换成硫酸铜溶液,则可实现在铁上镀铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常常利用物质的酸碱性分离混合物.某一混合物含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如图。

已知:①苯胺(![]() )有弱碱性,可与盐酸等反应生成盐;
)有弱碱性,可与盐酸等反应生成盐;
②常温下,苯胺、苯酚、苯甲酸、苯甲醇微溶于水,但均易溶于有机溶剂。
回答下列问题:
(1)写名称:物质2是 ,物质4是 。
(2)写出A、C的化学式:A , C 。
(3)写出反应②的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com