
| A£® | ŌŚ25”ę101KPaĻĀ£¬2gH2ĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³ö285.8kJČČĮ棬ĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½æɱķŹ¾ĪŖ£ŗ2H2£Øg£©+O2£Øg£©=2H2O£Øl£©”÷H=-571.6kJ•mol-1 | |
| B£® | ±ķŹ¾ÖŠŗĶČȵĻÆѧ·½³ĢŹ½£ŗH++OH-=H2O”÷H=-57.3kJ•mol-1 | |
| C£® | ½«Ė®æāÖŠµÄĖ®Õ¢£Øøְ壩ÓėĶā¼ÓÖ±Į÷µēŌ“µÄÕż¼«ĻąĮ¬£¬øŗ¼«Į¬½Óµ½Ņ»æé·ĻĢśÉĻæÉ·ĄÖ¹Õ¢±»øÆŹ“ | |
| D£® | ŅŃÖŖČČ»Æѧ·½³ĢŹ½£ŗS£Øs£©+O2£Øg£©=SO2£Øg£©”÷H=a kJ•mol-1 S£Øg£©+O2£Øg£©=SO2£Øg£©”÷H=ba kJ•mol-1 Ōņb£¾a |
·ÖĪö A”¢ŌŚ101kPa”¢25”ꏱ£¬2gH2ĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³ö285.8KJČČĮ棬Ōņ2H2£Øg£©Ź®02£Øg£©=2H2O£Øl£©£»”÷H=-571.6KJ/mol£»
B”¢ŅŖ±ķĆ÷Ī¢Į£µÄ¾Ū½¹×“Ģ¬£»
C”¢½šŹōÓėĶā¼ÓÖ±½ÓµēŌ“µÄøŗ¼«ĻąĮ¬£¬×÷Ņõ¼«£¬±»±£»¤£»
D”¢µČĪļÖŹµÄĮæµÄS£Øs£©µÄÄÜĮæµĶÓŚµČĪļÖŹµÄĮæS£Øg£©µÄÄÜĮ森
½ā“š ½ā£ŗA”¢ŌŚ101kPa”¢25”ꏱ£¬2gH2ĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³ö285.8KJČČĮ棬Ōņ2H2£Øg£©Ź®02£Øg£©=2H2O£Øl£©£»”÷H=-571.6KJ/mol£¬¹ŹAÕżČ·£»
B”¢ŅŖ±ķĆ÷Ī¢Į£µÄ¾Ū½¹×“Ģ¬£¬ÖŠŗĶČȵĻÆѧ·½³ĢŹ½£ŗH+£Øaq£©+OH-£Øaq£©=H2O£Øl£©”÷H=-57.3kJ•mol-1£¬¹ŹB“ķĪó£»
C”¢½šŹōÓėĶā¼ÓÖ±½ÓµēŌ“µÄøŗ¼«ĻąĮ¬£¬×÷Ņõ¼«£¬±»±£»¤£¬ĖłŅŌ½«Ė®æāÖŠµÄĖ®Õ¢£Øøְ壩ÓėĶā¼ÓÖ±½ÓµēŌ“µÄøŗ¼«ĻąĮ¬£¬Äܱ£»¤Ė®Õ¢£¬¹ŹC“ķĪó£»
D”¢µČĪļÖŹµÄĮæµÄS£Øs£©µÄÄÜĮæµĶÓŚµČĪļÖŹµÄĮæS£Øg£©µÄÄÜĮ棬ĖłŅŌĮņÕōĘų·Å³öµÄČČĮæ¶ą£¬ĖłŅŌb£¼a£¬¹ŹD“ķĪó£»
¹ŹŃ”A£®
µćĘĄ ±¾Ģāæ¼²éģŹ±äŗĶ·“Ó¦ČČ£¬ÄŃ¶Č²»“ó£¬×¢ŅāÓŠDĮņÕōĘųµÄÄÜĮæøß¹ĢĢåĮņµÄÄÜĮ棬ĒŅ±Č½Ļ·“Ó¦µÄ“óŠ”°üĄØŠŌÖŹ·ūŗÅ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ³£ĪĀĻĀĖ®µēĄė³öµÄc£ØH+£©•c£ØOH-£©=1”Į10-20µÄČÜŅŗ£ŗNa+”¢Cl-”¢S2-”¢SO32- | |
| B£® | æÕĘų£ŗC2H2”¢CO2”¢SO2”¢NO | |
| C£® | ŗ¬Al3+µÄĪŽÉ«ČÜŅŗ£ŗNa+”¢SO42-”¢K+”¢ClO-”¢HCO3- | |
| D£® | øßĆĢĖį¼ŲČÜŅŗ£ŗH+”¢Na+”¢SO42-”¢NO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·“Ó¦ČČŗĶģŹ±äµÄµ„Ī»¶¼ŹĒkJ | |
| B£® | Čē¹ū·“Ó¦ŹĒŌŚŗćĪĀŗćŃ¹Ģõ¼žĻĀ½ųŠŠµÄ£¬“ĖŹ±µÄ·“Ó¦ČČÓėģŹ±äĻąµČ | |
| C£® | ČĪŗĪ»Æѧ·“Ó¦¶¼“ęŌŚ»ī»ÆÄÜ£¬ĒŅ²»æÉÄܽӽüÓŚĮć | |
| D£® | ČĪŗĪ»Æѧ·“Ó¦µÄ·“Ó¦ČČ¾łæÉĶعżŹµŃéÖ±½Ó²ā¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 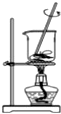 Õō·¢Ź³ŃĪĖ®µĆµ½ĀČ»ÆÄĘ¾§Ģå | B£® | 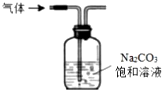 ³żČ„CO2ÖŠŗ¬ÓŠÉŁĮæHClĘųĢå | ||
| C£® | 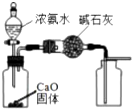 ÖĘČ”²¢ŹÕ¼ÆøÉŌļ“æ¾»µÄNH3 | D£® |  ŃéÖ¤SO2µÄ»¹ŌŠŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÅØÉÕ¼īČÜŅŗÖŠ¼ÓČėĀĮʬ£ŗAl+4OH-=AlO2-+2H2O | |
| B£® | ½«“ÅŠŌŃõ»ÆĢśČÜÓŚŃĪĖį£ŗFe3O4+8H+=3Fe3++4H2O | |
| C£® | ÓĆĢśµē¼«µē½āĀČ»ÆĢśČÜŅŗ£ŗ2Cl-+2H2O$\frac{\underline{\;µē½ā\;}}{\;}$2OH-+H2”ü+Cl2”ü | |
| D£® | µČĢå»ż”¢µČÅØ¶ČµÄBa£ØOH£©2Ļ”ČܽāÓėNH4HCO3Ļ”ČÜŅŗ»ģŗĻBa2++2OH-+NH4++HCO3-=BaCO3”ż+NH3•H2O+H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øÉ·ØÖŠÉś³ÉµÄøßĢśĖįÄĘ¼ČŹĒŃõ»Æ²śĪļÓÖŹĒ»¹Ō²śĪļ | |
| B£® | ŹŖ·ØÖŠĆæÉś³É1mol Na2FeO4 ×ŖŅĘ3molµē×Ó | |
| C£® | øÉ·ØÖŠĆæÉś³É1 mol Na2FeO4 ×ŖŅĘ4molµē×Ó | |
| D£® | K2FeO4“¦ĄķĖ®Ź±£¬²»½öÄÜĻū¶¾É±¾ś£¬Éś³ÉµÄFe£ØOH£©3½ŗĢ廹ÄÜĪüø½Ė®ÖŠµÄŠüø”ŌÓÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ś¢Ł¢Ś¢Ū | B£® | ¢Ł¢Ś¢Ś¢Ū | C£® | ¢Ś¢Ū¢Ś¢Ł | D£® | ¢Ł¢Ł¢Ś¢Ū |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ĻĀĮŠø÷×éĪļÖŹÖŠ£¬ÄÜŅ»²½ŹµĻÖČēĶ¼ĖłŹ¾¢Ł”«¢Ż×Ŗ»Æ¹ŲĻµµÄŹĒ£Ø””””£©
ĻĀĮŠø÷×éĪļÖŹÖŠ£¬ÄÜŅ»²½ŹµĻÖČēĶ¼ĖłŹ¾¢Ł”«¢Ż×Ŗ»Æ¹ŲĻµµÄŹĒ£Ø””””£©| X | Y | Z | W | |
| A | C | CO | CO2 | Na2CO3 |
| B | Fe3O4 | Fe | FeCl2 | FeCl3 |
| C | H2SO4 | SO2 | S | SO3 |
| D | Al | Al2O3 | NaAlO2 | Al£ØOH£©3 |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com