
 .
. (2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.
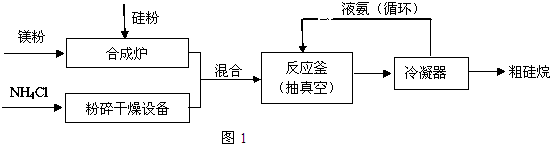
(2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.分析 根据题中流程可知,硅与镁在合成炉中生成Mg2Si,Mg2Si与氯化铵生成粗硅烷和氨气,经过冷凝器分离出液氨可循环使用,同时得到粗硅烷,
(1)①氯化铵中铵根离子和氯离子之间是离子键,铵根离子内部存在共价键,根据电子式的书写方法来回答;
②根据液氨的性质:易液化来回答;
③氨气的催化氧化产物是一氧化氮和水,一氧化氮遇到空气迅速变为二氧化氮,二氧化到可以和水反应得到硝酸,硝酸可以和氨气反应生成硝酸铵;
(2)三硅酸镁中和胃酸(HCl)生成氯化镁和硅酸,反应的化学方程式为:Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O,根据题意,被氢氧化钠中和的盐酸的物质的量为0.003mol,所以与三硅酸镁反应的盐酸为0.005mol-0.003mol=0.002mol,根据化学方程式,列比例式可计算出n的值.
解答 解:根据题中流程可知,硅与镁在合成炉中生成Mg2Si,Mg2Si与氯化铵生成粗硅烷和氨气,经过冷凝器分离出液氨可循环使用,同时得到粗硅烷,
(1)①氯化铵中铵根离子和氯离子之间是离子键,铵根离子内部存在共价键,极性键(或共价键)、离子键,硅甲烷中硅原子和氢原子之间以共价键结合,电子式为: ,
,
故答案为:极性键(或共价键)、离子键; ;
;
②液氨的性质:易液化,上述生产硅烷的过程中液氨的作用是:吸收热量,保证反应在常温下进行,
故答案为:吸收热量,保证反应在常温下进行(答“制冷”或“降温”均可);
③氨气的催化氧化产物是一氧化氮和水,即4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,因为一氧化氮遇到空气迅速变为二氧化氮,二氧化氮可以和水反应得到硝酸,硝酸可以和氨气反应生成硝酸铵,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;NH4NO3(或硝酸铵);
(2)三硅酸镁中和胃酸(HCl)生成氯化镁和硅酸,反应的化学方程式为:Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O,根据题意,被氢氧化钠中和的盐酸的物质的量为0.003mol,所以与三硅酸镁反应的盐酸为0.005mol-0.003mol=0.002mol,根据化学方程式,设0.184gMgSi3O8•nH2O的物质的量是x,得
Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O
1 4
x 0.002mol
$\frac{1}{x}$=$\frac{4}{0.002mol}$,解得x=0.0005mol,所以MgSi3O8•nH2O的摩尔质量是$\frac{0.184}{0.0005}$g/mol=368g/mol,Mg2Si3O8的摩尔质量为260g/mol,所以18n=108,即n=6.
故答案为:Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O;6.
点评 本题考查学生复杂化学时的确立方面的知识,要求学生具有分析和解决问题的能力,难度大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3═3Al3++2SO42- | B. | AlCl3═Al3++Cl3- | ||
| C. | Mg(NO3)2═Mg2++2NO3- | D. | KMnO4═K++Mn2++4O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g•cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 如果浓H2SO4沾到皮肤上,可立即用大量水冲洗,然后涂上硼酸溶液 | |
| D. | 如果少量酒精失火燃烧,可用湿抹布盖灭火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上冶炼钠,是通过电解氯化钠饱和溶液 | |
| B. | 工业上冶炼铝,如果以石墨为电极,则阳极石墨需要不断补充 | |
| C. | 工业上冶炼镁,是电解熔融氧化镁 | |
| D. | 工业上精炼铜是粗铜为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| B. | pH=1的溶液:Na+、K+、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$ | |
| C. | 含有大量Al3+的溶液:Na+、NH4+、SO${\;}_{4}^{2-}$、Cl- | |
| D. | 含有大量NO3-的溶液:H+、Fe2+、SO${\;}_{4}^{2-}$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com