
分析 燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,计算2mol硫化氢燃烧放热,结合热化学方程式书写方法写出.
解答 解:H2S的燃烧热△H=-a kJ•mol-1,由燃烧热概念可知2mol硫化氢燃烧放热2aKJ,则H2S燃烧反应的热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-2akJ•mol-1,
答:H2S燃烧反应的热化学方程为:2H2S(g)+3O2(g)=2 SO2(g)+2H2O(l)△H=-2akJ•mol-1.
点评 本题考查了燃烧热概念和热化学方程式的书写计算应用,掌握概念实质和热化学方程式书写方法是解题关键.题目难度中等.


科目:高中化学 来源: 题型:解答题
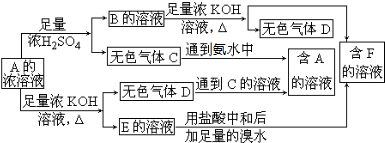
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
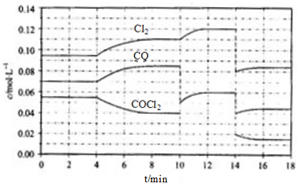 COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):
COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
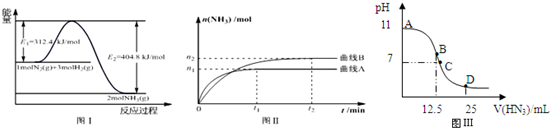
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
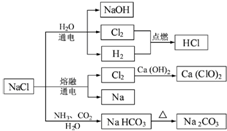
| A. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 图中所示转化反应不都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:S>O>N | B. | 沸点:H2O>HF>H2S | ||
| C. | 离子半径:Cl->Al3+>Mg2+ | D. | 还原性:I->S2->Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com