
下列说法正确的是
A.在配制一定物质的量浓度溶液的实验中托盘天平,玻璃棒是必需仪器
B.实验室中,盛装NaOH等碱性溶液的试剂瓶用橡皮塞
C.加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+
D.用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH试纸
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
向含amolFeCl2的溶液中加入含bmolBr2的溴水,充分反应。下列说法不正确的是
A.离子的还原性强弱:I- >Fe2+ >Br-
B.当a≥b时,发生的离子反应:2I-+ Br2= I2+2Br-
C.当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2=2Fe3++I2+4Br-
D.当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
NA表示阿伏伽德罗常数,下列说法正确的是
A.标准状况下,22.4L HF中含有氟原子数目为NA
B.0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
C.1mol 如图物质与浓溴水反应时通常最多消耗Br2为6mol
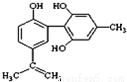
D.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:实验题
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。

【背景素材】
①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO3-, MnO4-被还原成Mn2+
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【制备NaNO2】
(1)装置A三颈烧瓶中发生反应的化学方程式为_______________________。
(2)B装置的目的是①________________②_____________。
(3)E装置的作用是 。
【测定NaNO2纯度】
(4)本小题可供选择的试剂有:
A.稀硫酸
B.c1mol/LKI溶液
C.淀粉溶液
D.c2mol/LNa2S2O3溶液
E.c3mol/L酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是 (填序号)
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m的NaNO2样品放入锥形瓶中,加适量水溶解 (请补充完整实验步骤)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
B.水电离出的c(H+)=1×10-4mol/L的溶液中:Ba2+、NO3-、K+、SO32-
C.使苯酚显紫色的溶液中:NH4+、Na+、Cl-、SCN-
D.使甲基橙变红的溶液中:Na+、NH4+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
由C16O和C18O组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关系正确的是
A.混合气体中C16O与C18O的分子数之比为14:15
B.混合气体中C16O与C18O的物质的量之比为1:1
C.混合气体中C16O与C18O的质量之比为15:14
D.混合气体中C16O与C18O的密度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com