
【题目】用某废催化剂(主要成分Al2O3、K2O、少量CoO、SiO2等)来制取明矾的工艺流程如下图所示,回答下列问题:
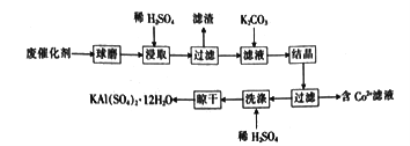
(1)废催化剂在浸取前进行球磨的主要目的是________________________________________。
(2)浸取时Al2O3溶解的化学方程式为________________________________________;
(3)滤渣的主要成分是_________________ (填化学式)。
(4)实验测得K2CO3的加入量与KA1(SO4)2·12H2O产率及纯度关系如下表所示:
编号 | 1 | 2 | 3 | 4 |
K2CO3加入量/g | 2 | 4 | 6 | 8 |
产品质量/g | 3.3 | 5.7 | 4.6 | 4.5 |
明矾纯度/g | 99.1 | 98.2 | 91.4 | 84.9 |
当K2CO3的加入量超过4 g后,晶体的质量减少且纯度降低,其原因是________________________。
【答案】 增大接触面积,加快反应速率,提高酸浸时的浸取率(合理即可) Al2O3+3H2SO4=Al2(SO4)3+3H2O SiO2 Al3++3H2O![]() Al(OH)3+3H+ ,K2CO3加入过多会导致溶液酸度降低,使Al3+水解生成A1(OH)3
Al(OH)3+3H+ ,K2CO3加入过多会导致溶液酸度降低,使Al3+水解生成A1(OH)3
【解析】
(1) 废催化剂在浸取前进行球磨的主要目的是将块状固体粉碎,增大接触面积,加快化学反应速率,提高酸浸时的浸取率;
(2)浸取时Al2O3溶解于硫酸生成盐和水,化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O
(3)滤渣的主要成分是不溶于酸的SiO2;
(4)K2CO3溶于水后水解使溶液呈碱性,当K2CO3的加入量超过4 g后,晶体的质量减少且纯度降低,其原因是K2CO3加入过多会导致溶液酸度降低,使Al3+水解生成A1(OH)3。


科目:高中化学 来源: 题型:
【题目】某学习小组用下图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
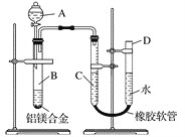
(1)A中试剂为________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是___________。
(3)将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥、称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性,上述操作的顺序是___________ (填序号);记录C的液面位置时,除视线平视外,还应__________。
(4)若实验用铝镁合金的质量为ag,测得氢气体积为bmL(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为________。
(5)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”“偏小”或“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如右图所示,则:
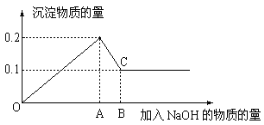
(1)图中C点表示当加入________mol NaOH时,Al3+已完全转化为____________(填微粒符号)
(2)图中线段OA和AB两段NaOH的物质的量之比为 ____________。
(3)写出AB段发生反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
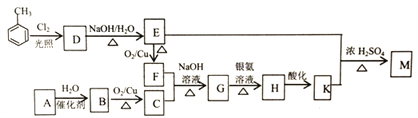
已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂
②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:
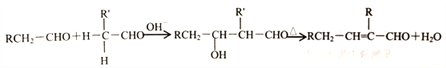
请回答下列问题:
(1)K的名称是_______;G中含有的官能团名称是_______ 。
(2)写出D→E的化学方程式_______ 。
(3)A-B的反应类型是_______;M的结构简式是_______ 。
(4)同时满足下列三个条件的K的同分异构体有_____种(不考虑立体异构)。
①遇FeCl溶液发生显色反应;
②能发生银镜反应;
③除苯环以外不再含有其他环状结构。
其中核磁共振氢谱为五组峰的结构简式为_______。
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,完善以下合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)______。
CH3CH2OH![]() CH3CHO
CH3CHO![]() ……
……![]() ……
……![]() CH3CH2CH=CH2
CH3CH2CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请把符合要求的化学方程式的编号填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于化合反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于分解反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
B.2Na+Cl2![]() 2NaCl
2NaCl
C.Zn+CuSO4===ZnSO4+Cu
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
E.CaO+CO2===CaCO3
F.4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②氧化剂与氧化产物的物质的量比是________。
③当有2 mol HNO3参加反应时,被氧化的物质质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于四种基本反应类型,但不属于氧化还原反应的是( )
A. Fe+CuSO4═FeSO4+Cu B. CO+CuO![]() Cu+CO2
Cu+CO2
C. AgNO3+NaCl═AgCl↓+NaNO3 D. 2FeCl2+Cl2═2FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________,该反应中SO2表现出______性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________,该反应中SO2表现出__________性。
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
余石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com