
下列微粒只具有氧化性的是
A.Fe2+ B.Fe3+ C.CO D.Cu
科目:高中化学 来源: 题型:
在2A+B  3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(A)=0.3mol/L· s B.v(B)=0.3mol/L· s
C.v(C)=0.3mol/L· s D.v(D)=1mol/L· s
查看答案和解析>>
科目:高中化学 来源: 题型:
关于硝酸的说法正确的是( )
A.硝酸与金属反应时,主要是+5价的氮得电子
B.浓HNO3与浓HCl按3∶1的体积比所得的混合物叫王水
C.硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2
D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
用特殊方法把固体物质加工到纳米级(1nm~100nm)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的粒子的大小和这种纳米粒子大小具有相同的数量级的是
A.溶液 B.悬浊液 C.胶体 D.乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。

根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置(将A、B、C、D填入适当的空格中)。
①除去Ca(OH)2溶液中悬浮的CaCO3 ; ②从碘水中提取碘 ;
③用自来水制取蒸馏水 ; ④分离植物油和水 ;
⑤除去食盐水中的泥沙 ; ⑥与海水晒盐原理相符的是 。
(2)由可溶性铝盐制取氢氧化铝,需加入的试剂为: ;
离子方程式为: 。
白色的Fe(OH)2在空气中发生的颜色变化为 。
反应的化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,pH=2的H2SO4溶液中含有的H+离子数目为0.01NA
B.当H2O与Na2O2反应生成1 molO2时,转移的电子数目为4NA
C.标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数为0.1NA
D.1 L 0.1 mol·L-1 FeCl3溶液中含有的Fe3+离子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
硅孔雀石是一种含铜的矿石,含铜形态为
 ,同时含有
,同时含有 等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:
等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:

请回答下列问题:
⑴完成步骤①中稀硫酸与 发生反应的化学方程式
发生反应的化学方程式
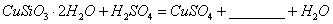 ;
;
用离子方程式表示双氧水的作用_____________________________。
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A.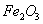 B.CuO C.A12O3 D.
B.CuO C.A12O3 D.
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:

由上表可知:当溶液pH=4时,可以完全除去的离子是______,不能完全除去的离子是________。
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到 晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,
晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,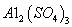 饱和溶液中
饱和溶液中
 mol
mol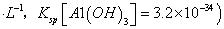 ______________。
______________。
⑸若要测定硫酸铜晶 体中结晶水的含量,需要的仪器是酒精灯、托盘天平、三角架、泥三角、玻璃棒、干燥器、坩埚钳、研钵、药匙、_________________。实验过程中硫酸铜晶体加热失水后在空中冷却后称量,则测定结果______________(填“偏高”、 “偏低”或“不变”)。
体中结晶水的含量,需要的仪器是酒精灯、托盘天平、三角架、泥三角、玻璃棒、干燥器、坩埚钳、研钵、药匙、_________________。实验过程中硫酸铜晶体加热失水后在空中冷却后称量,则测定结果______________(填“偏高”、 “偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com