
分析 燃烧反应为放热反应,△H<0,根据4.4g丙烷完全燃烧放出的热量计算44g即1mol丙烷完全燃烧放出的热量,进而书写热化学方程式;
(1)根据盖斯定律来判断两种途径放热之间的关系;
(2)该反应属于吸热反应,反应物具有的总能量小于生成物的总能量;需要吸收能量,所以反应条件为加热;
(3)途径I:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-a kJ•mol-1
途径II:②C3H8(g)═C3H6(g)+H2(g)△H=+b kJ•mol-1
③2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=-c kJ•mol-1
④2H2(g)+O2 (g)═2H2O(l)△H=-d kJ•mol-1 反应①=反应②+反应③×$\frac{1}{2}$+反应④×$\frac{1}{2}$,据盖斯定律来判断各步反应之间的关系.
解答 解:4.4g丙烷完全燃烧放出akJ能量,则1mol丙烷完全燃烧生成CO2气体和液态水放出的热量为10akJ,
则丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-10akJ/mol,
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-10akJ/mol;
(1)根据盖斯定律,煤作为燃料不管是一步完成还是分两步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样,
故答案为:等于;
(2)由于C3H8(g)═C3H6(g)+H2(g) 的反应中△H>0,该反应是吸热反应,反应物具有的总能量小于生成物的总能量,需要吸收能量,反应条件是加热,
故答案为:小于;吸收;加热;
(3)所以-a=b+$\frac{1}{2}$(-c-d),所以b=-a+$\frac{1}{2}$(c+d),2b=c+d-2a,
故答案为:2b=c+d-2a.
点评 本题考查学生盖斯定律的应用以及反应吸放热与反应物、生成物能量之间的关系,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④⑤ | C. | ③④⑤ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
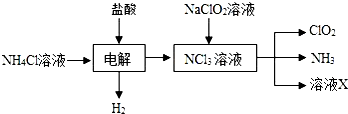

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 不纯物质(杂质) | 除杂试剂或分离方法 | 必用仪器 |
| A | 碘水 | 四氯化碳 萃取 | 分液漏斗 |
| B | 一氧化碳(二氧化碳) | 澄清石灰水 洗气 | 洗气瓶 |
| C | 硝酸钾(氯化钠) | 直接蒸发结晶 | 蒸发皿 |
| D | 乙醇(水) | 生石灰 蒸馏 | 蒸馏烧瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离平衡逆向移动 | B. | c(OH-)增大 | ||
| C. | 电离平衡常数增大 | D. | n(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1 min内的平均速率为v(H2)=0.40/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究小组向2L密闭容器中加入一定量的固体A和气体B发生反应:
某研究小组向2L密闭容器中加入一定量的固体A和气体B发生反应:时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成16 mol N2转移30 mol电子 | |
| B. | NaN3中N元素被还原 | |
| C. | N2既是氧化剂又是还原剂 | |
| D. | 还原产物与氧化产物质量之比为1:15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com