
已知NH4CuSO3与足量的10mol/L硫酸混合微热,产生下列现象:
①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色
据此判断下列说法正确的是( )
A.反应中硫酸作氧化剂 B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气 D.1mol NH4CuSO3完全反应转移0.5mol电子
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
利用化合价和物质类别推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①将 通入酸性
通入酸性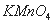 溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________.
溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________.
A.  B.
B. 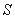 C.
C. 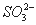 D.
D. 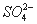
②亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现在有试剂:溴水、H2S、稀硫酸。请选取合适的试剂证明Na2SO3具有还原性,并写出该反应的离子方程式为:_____________________________.
(2)从物质分类的角度可以推测物质的性质。
①已知蛇纹石由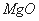 、
、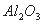 、
、 、
、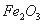 组成。其中属于碱性氧化物的是______________________________。
组成。其中属于碱性氧化物的是______________________________。
②现取一份蛇纹石试样进行实验:
I. 先将其溶于过量的盐酸中、过滤,滤渣的主要成分是______________。
II. 再向滤液中加入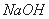 溶液至过量、过滤,滤渣中的主要成分是__________________。
溶液至过量、过滤,滤渣中的主要成分是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁发生吸氧腐蚀时,正极上发生的电极反应是 ( )
A. 2H++2e-=H2 B. Fe2++2e-=Fe
C. 2H2O+O2+4e-=4OH- D. Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题:

(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中正确的是( )
A.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑
B.向100mL0.1mol/L的FeI2溶液中缓慢通入标准状况下的224mLCl2:
2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
C.酸性KMnO4溶液与H2O2反应: 2MnO4- +6H+ + 7H2O2 = 2Mn2+ + 6O2↑ + 10 H2O
D.KI溶液与H2SO4酸化的H2O2溶液混合:2 I- + H2O2 + 2 H+ =2 H2O + I2
查看答案和解析>>
科目:高中化学 来源: 题型:
铁氧磁体法处理含Cr2O72-的废水的原理如下:向含Cr2O72-的酸性废水中加入FeSO4·7H2O,将Cr2O72-还原为Cr3+,调节溶液的酸碱性,使铁、铬元素转化为组成相当于FeIIFexIII·Cr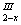 O4(铁氧磁体,罗马数字表示元素的价态)的沉淀。处理含1molCr2O72-的废水至少需要加入amolFeSO4·7H2O。下列结论正确的是( )
O4(铁氧磁体,罗马数字表示元素的价态)的沉淀。处理含1molCr2O72-的废水至少需要加入amolFeSO4·7H2O。下列结论正确的是( )
A.x = 0.5, a = 8 B.x = 0.5,a = 10 C.x = 1.5,a = 8 D.x = 1.5,a = 10
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验能达到预期目的的是( )
| 实验内容 | 实验目的 | |
| ① | 分别测定0.01mol/L的HCl和H2S的c(H+) | 比较氯和硫的非金属性强弱 |
| ② | 混合气体通入盛有饱和碳酸氢钠溶液的洗气瓶 | 除去CO2中少量的SO2 |
| ③ | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
| ④ | 将硫酸铜晶体分别放入浓硫酸和稀硫酸中 | 鉴别浓硫酸和稀硫酸 |
A.②④ B.①③ C.①② D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
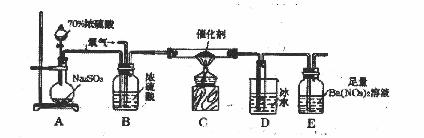
(1)实验室用上述装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作: 。
②实验过程中,需要通入氧气。试写出一个用如图所示装置制取氧气的化学方程式: 。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是: 。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为:
。
 ②为验证二氧化硫的还原性,充分反应后,取试管b
②为验证二氧化硫的还原性,充分反应后,取试管b
中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
试管b发生反应的离子方程式: 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)= 用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在5 mL 0.1 mol/L的KCl溶液中,加入5 mL 0.1 mol/L的AgNO3溶液,可观察到____________,此反应的离子方程式为_____________________。
将此混合液过滤,滤渣加入5 mL 0.1 mol/L的KI溶液,搅拌,可观察到________________________,反应的离子方程式为_____________________。
(2)对于Ag2S(s) 2Ag+(aq)+S2-(aq),其Ksp的表达式为_____________________。
2Ag+(aq)+S2-(aq),其Ksp的表达式为_____________________。
(3)下列说法不正确的是________。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.对于Al(OH)3(s)  Al(OH)3(aq)
Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡
Al3++3OH-,前者为溶解平衡,后者为电离平衡
C.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的
D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
E.用OH-除去溶液中的Mg2+比用CO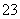 效果好,说明Mg(OH)2的溶解度比MgCO3大
效果好,说明Mg(OH)2的溶解度比MgCO3大
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是______。
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com