
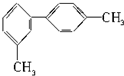
| A. | 分子中至少有6个碳原子处于同一平面上 | |
| B. | 分子中至少有8个碳原子处于同一平面上 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 分子中至少有14个碳原子处于同一平面上 |
科目:高中化学 来源: 题型:解答题
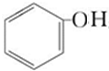 D
D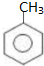
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
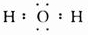
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu互为同素异形体 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U具有完全相同的化学性质 | |
| D. | ${\;}_{92}^{238}$Pu与${\;}_{92}^{239}$Pu具有相同的最外层电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟离子的结构示意图: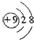 | |
| B. | 氮分子的电子式: | |
| C. | 水分子的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| D. | C-14原子:${\;}_{6}^{14}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
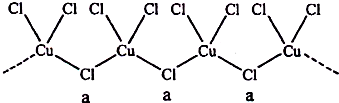
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com