
含FeS280%的硫铁矿,煅烧时损失硫5%,SO2氧化成SO3时利用率为98%,问生产1 t 98%的硫酸,需要这种硫铁矿多少t?
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A.261.3 t
B.326.7 t
C.266.7 t
D.166.7 t
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ||
查看答案和解析>>
科目:高中化学 来源:2009-2010学年甘肃省兰州五十五中高二(上)期中化学试卷(解析版) 题型:解答题
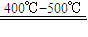 2SO3; SO3+H2O═H2SO4用含FeS280%的硫铁矿生成硫酸,已知该矿石的利用率为95%,SO2的转化率为90%,SO3的吸收过程中损失率为2%.求生产500t98%的硫酸需矿石的质量.(要写出简单计算过程)
2SO3; SO3+H2O═H2SO4用含FeS280%的硫铁矿生成硫酸,已知该矿石的利用率为95%,SO2的转化率为90%,SO3的吸收过程中损失率为2%.求生产500t98%的硫酸需矿石的质量.(要写出简单计算过程)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com