
【题目】同位素常用做环境分析指示物,下列对同位素的说法正确的是( )
A.34S原子核内的中子数为16
B.13C和15N原子核内的质子数相差2
C.16O与18O的核电荷数相等
D.2H+质量与1H+的质量相同
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都具有10个电子,其结构特点如下:
粒子代码 | a | b | c | d | e | f | g |
原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;c和f在一定条件下形成一个g分子和一个d分子,试写出:
(1)a粒子的原子结构示意图___________
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为___>_____ (用化学式表示)。
(3)d与一种含有极性键双核18电子分子反应的化学方程式为 ______。
(4)g与一种含有非极性键双核18电子分子反应的化学方程式为__________
上述反应中,断裂化学键是__________,写出的化学键是________(填“离子键”、“极性键”、“非极性键”、“氢键”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各小题
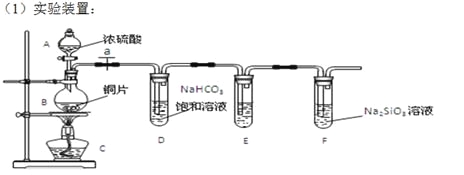
填写所示仪器名称A B 。
(2)实验步骤:连接仪器、___________、加药品后,打开a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是 ;装置E中足量酸性KMnO4溶液的作用是 ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性 (填“能”或“否”,1分),改进方法是: 。试管F中发生反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X元素与Y元素最高正价与最低负价之和均为0;元素Q的离子与![]() 所含的电子数和质子数均相同;Z、R分别是地壳中含量最高的非金属元素和金属元素。
所含的电子数和质子数均相同;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子的半径由大到小的顺序是(写元素符号)____________。
(2)X与Z形成的一种化合物,既含极性键又含非极性键,则化合物的化学式是_________,该化合物具有很强的氧化性,写出其与SO2反应的化学方程式:____________________;此化合物在某些反应中也可表现还原性,写出其与酸性高锰酸钾反应的离子方程式:_______________。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A![]() B(在水溶液中进行)其中C是溶于水显酸性的气体;D是黄色固体。写出D的电子式:_____________;如果A、B均由三种元素组成,B为两性不溶物,则该A的化学式为______________;由A与少量C反应生成为B的离子方程式为_________________。
B(在水溶液中进行)其中C是溶于水显酸性的气体;D是黄色固体。写出D的电子式:_____________;如果A、B均由三种元素组成,B为两性不溶物,则该A的化学式为______________;由A与少量C反应生成为B的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. Na2O2与H2O反应:2Na2O2+2H2O===4Na++4OH-+O2↑
B. 澄清石灰水中通入少量的CO2:CO2+OH-===HCO![]()
C. Mg(OH)2与盐酸反应:OH-+H+===H2O
D. Zn与AgNO3溶液反应:Zn+Ag+===Zn2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比推理是化学中常用的思维方法。下列推理正确的是
A. Cl2与水反应生成HCl和HClO,推测F2与水反应生成HF和HFO
B. SiH4的沸点高于CH4,推测H2S的沸点高于H2O
C. NH3分子为三角锥型,推测PH3分子三角锥型
D. S与Fe反应生成FeS,推测S与Cu生成CuS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4﹣转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
实验 编号 | 温度 | 初始pH | 0.1mol/L 草酸溶液/mL | 0.01mol/L KMnO4溶的 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
① | 常温 | 1 | 20 | 50 | 30[ | t1 |
② | 常温 | 2 | 20 | 50 | 30 | t2 |
③ | 常温 | 2 | 40 | a | b | t3 |
表中a、b的值分别为:a= 、b=
(2)该反应的离子方程式 。
(3)若t1<t2,则根据实验①和②得到的结论是 。
(4)请你设计实验④验证MnSO4对该反应起催化作用,完成下表中内容.
实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
(5)某化学小组用滴定法测定KMnO4溶液物质的量浓度:取W g草酸晶体(H2C2O42H2O,其摩尔质量126 g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液V mL.请回答下列问题:
① 该测定方法中 (填“需要”或“不需要”)加入指示剂;
② 计算得KMnO4溶液的c(KMnO4)= mol/L.(请写出最后化简结果)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com