
| A. | 金刚石与石墨互为同素异形体 | B. | H、D、T互为同位素 | ||
| C. | CH3-CH3与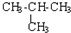 互为同系物 互为同系物 | D. | 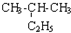 与 与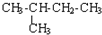 互为同分异构体 互为同分异构体 |
分析 A.由同种元素形成的不同种单质互为同素异形体,互为同素异形体的物质要符合以下两个条件:同种元素形成,不同单质;
B.质子数相同中子数不同的原子互称同位素;
C.同系物指分子结构相似,在组成形成1个或若干个CH2原子团的有机物;
D.同分异构体是指分子式相同,但结构不同的化合物.
解答 解:A.金刚石与石墨都是由碳元素形成的不同物质,都是单质,互为同素异形体,故A正确;
B.H、D、T质子数相同,质子数不同,是氢元素的不同核素,互为同位素,故B正确;
C.乙烷与2-甲基丙烷都属于烷烃,分子结构相似,在组成形成1个CH2原子团,属于同系物,故C正确;
D.根据烷烃的命名原则分析:碳链最长称某烷,靠近支链把号编.简单在前同相并,其间应划一短线,该选项两者主链都含有4个C,2号碳含有1个甲基,命名都为:2-甲基丁烷,所以两者为同一物质,故D错误;
故选D.
点评 本题考查了同素异形体、同位素、同系物、同分异构体的概念与区别,难度不大,注意把握概念的内涵与外延.


科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.7 | 7.5 | 5.4 | 4.0 | 6.4 |
| 完全沉淀时的pH | 3.7 | 9.5 | 6.6 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
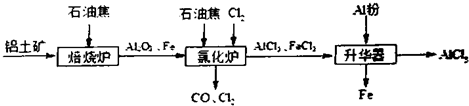
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
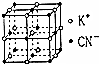 六氰合铁(Ⅲ)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、印染工业及钢铁工业均有重要作用,请回答下列问题:
六氰合铁(Ⅲ)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、印染工业及钢铁工业均有重要作用,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验 | 解释或结论 |
| A | 向包有Na2O2的脱脂棉滴少量水,脱脂棉燃烧 | Na2O2与H2O反应放热并有O2生成 |
| B | 向NaI溶液滴加FeCl3溶液,再加入CCl4,振荡,静置,下层呈紫红色 | 氧化性:I2>Fe3+ |
| C | 取酸雨试样,滴加H2O2溶液,再加入BaCl2溶液,有白色沉淀 | 该酸雨试样中一定含有H2SO3 |
| D | 用激光笔照射水玻璃(Na2SiO3的溶液),有丁达尔现象 | SiO32-水解生成了硅酸胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C3H6 | B. | C2H4和C2H6 | C. | CH4和C3H4 | D. | CH4和C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
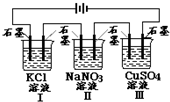 如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )
如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )| A. | 12、7、2 | B. | 13、7、1 | C. | 1、7、13 | D. | 7、13、1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com